Anda pasti tidak asing dengan kata kalor, bukan? Biasanya kita sering menyebutnya dengan istilah panas. Secara umum, kalor adalah energi panas antara dua benda yang berpindah karena adanya perbedaan suhu.
Kalor dapat berpindah melalui beberapa mekanisme. Selain itu, kalor juga memiliki jenis yang berbeda-beda sesuai dengan kondisi lingkungannya. Nah, untuk mempelajari lebih dalam lagi tentang kalor, mulai dari jenis perpindahannya, rumus, hingga contoh soal, simak terus penjelasan di bawah ini!
Pengertian Kalor
Istilah “kalor” sering kali digunakan secara bergantian dengan istilah “panas” dalam konteks sehari-hari, meskipun dalam fisika dan termodinamika, “panas” mengacu pada perubahan energi termal antara sistem dan lingkungannya.
Kalor adalah istilah dalam ilmu fisika yang merujuk pada bentuk energi panas yang dapat ditransfer antara sistem fisik dan lingkungannya karena adanya perbedaan suhu.
Ketika dua sistem dengan suhu yang berbeda berinteraksi, kalor dapat mengalir dari sistem dengan suhu lebih tinggi ke sistem dengan suhu lebih rendah hingga mencapai kesetimbangan termal di mana suhu keduanya menjadi sama. Satuan standar untuk kalor dalam sistem Satuan Internasional (SI) adalah joule (J).
Namun, dalam konteks tertentu. seringkali digunakan satuan lain seperti kalori, di mana 1 kalori setara dengan sekitar 4,184 joule.
Rumus Kalor
Kalor memiliki beberapa rumus yang digunakan sesuai dengan kondisi yang dialami. Berikut beberapa rumus kalor yang sering digunakan.
1. Rumus Perpindahan Kalor
Q = m.c.ΔT
Keterangan:
Q = banyaknya kalor yang diperlukan (J)
m = massa zat yang dikenai kalor (kg)
c = kalor jenis zat (J/Kg °C)
ΔT = perpindahan suhu (°C)
2. Rumus Kalor Jenis
c = Q / m.ΔT
Keterangan:
c = kalor jenis zat (J/KgC)
Q = banyaknya kalor yang diperlukan (J)
m = massa zat yang dikenai kalor (kg)
ΔT = perpindahan suhu (C)
3. Rumus Kapasitas Kalor
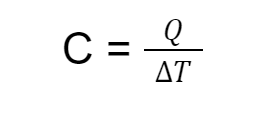
Keterangan:
C = kapasitas kalor (J/K)
Q = banyaknya kalor (J)
T = perpindahan suhu (K)
4. Rumus Menentukan Kapasitas Kalor Itu Sendiri
C = m.c
Keterangan:
C = kapasitas kalor (J/K)
m = massa benda (kg)
c = kalor jenis zat (J/kg.K)
5. Rumus Kalor Lebur dan Uap
Kalor lebur:
Q = m.L
Kalor uap:
Q = m.U
Keterangan:
L = Kalor lebur zat (Joule/ kilogram)
U = Kalor uap zat (Joule/ kilogram).
Jenis Kalor
Dalam ilmu fisika, terdapat beberapa jenis kalor yang dapat dibedakan berdasarkan sumbernya dan cara transfernya. Berikut adalah beberapa jenis kalor yang umum dikenal, antara lain:
1. Kalor Pembentukan (ΔHf)
Kalor pembentukan yakni kalor yang dibutuhkan untuk pembuatan 1 mol senyawa dalam suatu unsur. Contohnya seperti gas yang tertulis dengan rumus molekulnya, seperti C₁₂, O₂, Br₂, H₂.
2. Kalor Penguraian (ΔHd)
Kalor penguraian (heat of decomposition) mengacu pada jumlah kalor (energi panas) yang diperlukan atau dilepaskan saat suatu zat mengalami proses penguraian (dekomposisi). Dalam proses penguraian, reaksi dapat melepaskan atau menyerap energi panas, yang diukur dalam satuan energi seperti joule atau kalori.
Untuk menguraikan 1 mol senyawa menjadi unsur-unsur lain, hasil kalor penguraian sangat dibutuhkan dalam proses ini.
3. Kalor Pembakaran (ΔHc)
Kalor pembakaran adalah salah satu jenis kalor yang dibutuhkan dan didapatkan untuk membakar 1 mol zat yakni pada unsur ataupun senyawa.
4. Kalor Netralisasi (ΔHn)
Kalor ini adalah jenis kalor yang dihasilkan juga dibutuhkan dalam membuat 1 mol H2O melewati reaksi antara asam dan basa. Kalor netralisasi ini masuk dalam reaksi eksoterm atau yang biasa dimaksud dengan reaksi kimia yang menghasilkan kalor. Kalor ini termasuk dalam reaksi eksoterm dikarenakan adanya kenaikan suhu.
5. Kalor Pelarutan (ΔHs)
Kalor ini mempunyai jenis kalor yang didapat atau dibutuhkan untuk pelarutan 1 mol zat yang pada awalnya padat kemudian menjadi larutan.
Perpindahan Kalor
Perpindahan kalor adalah proses transfer energi panas dari satu tempat ke tempat lainnya karena perbedaan suhu antara dua sistem atau objek. Perpindahan kalor dapat terjadi melalui tiga mekanisme utama yakni konveksi, konduksi, dan radiasi. Berikut adalah penjelasan singkat tentang masing-masing mekanismenya.
1. Konduksi
Konduksi adalah perpindahan kalor yang terjadi langsung melalui kontak fisik antara dua benda yang memiliki perbedaan suhu. Ketika suatu benda dipanaskan, partikel-partikel di sekitarnya mendapatkan energi dan mulai bergetar lebih aktif.
Energi ini kemudian akan ditransfer melalui partikel-partikel tetangga melalui tumbukan dan getaran. Konduksi terjadi terutama dalam benda padat atau pada antarmuka antara dua benda yang berbeda suhu.
Sebagai contoh ketika Anda memasak makanan di atas kompor, panas dari kompor akan dihantarkan melalui dasar panci ke mulut panci yang tidak terkena api secara langsung.
Dalam konduksi panas ini, partikel di dasar panci yang memiliki energi termal lebih tinggi mentransfer energi panasnya ke partikel sekitarnya yang memiliki energi lebih rendah. Proses ini berlangsung sampai seluruh panci memiliki suhu yang sama dan makanan matang secara merata.
2. Konveksi
Konveksi kalor adalah perpindahan panas melalui gerakan massa fluida (gas atau cairan). Ketika bagian dari fluida dipanaskan, itu menjadi kurang padat dan naik karena gaya apung, sementara fluida yang lebih dingin turun menggantikannya. Proses ini menciptakan aliran konvektif yang dapat mengirimkan kalor ke lokasi lain.
Konveksi terjadi terutama dalam cairan dan gas, seperti dalam pemanasan udara di ruang, proses pembentukan awan, dan aliran air panas dalam panci.
3. Radiasi
Radiasi kalor adalah perpindahan panas melalui gelombang elektromagnetik, seperti sinar inframerah. Radiasi termal dapat berpindah melalui ruang hampa udara dan tidak memerlukan medium fisik untuk mentransfer kalor.
Radiasi termal sangat penting dalam transfer energi dari matahari ke bumi dan juga digunakan dalam aplikasi teknologi, seperti panel surya dan oven mikro.
Dalam kehidupan sehari-hari, perpindahan kalor berperan penting dalam berbagai aspek, termasuk proses memasak, sistem pemanas dan pendingin udara, serta banyak proses industri dan ilmiah lainnya.
Memahami mekanisme perpindahan kalor ini memungkinkan kita untuk merancang sistem yang efisien dalam memanfaatkan dan mengontrol energi panas untuk berbagai keperluan.
Kalor Jenis dan Kapasitas Kalor
Kalor jenis dan kapasitas kalor adalah dua konsep yang terkait dengan kemampuan suatu benda dalam menyerap atau melepaskan kalor (energi panas) saat mengalami perubahan suhu. Akan tetapi, keduanya memiliki definisi dan penggunaan yang berbeda dalam fisika dan termodinamika.
Kalor Jenis
Kalor jenis adalah jumlah kalor yang diperlukan untuk meningkatkan suhu satu kilogram dari suatu benda menjadi satu derajat Celcius (atau Kelvin). Kalor jenis dinyatakan dalam satuan energi per massa dan per perubahan suhu (J/kg°C atau J/g°C).
Kapasitas Kalor
Kapasitas kalor adalah jumlah kalor yang diperlukan untuk meningkatkan suhu suatu benda, tidak hanya satu kilogram, tetapi keseluruhan massa benda menjadi satu derajat Celcius (atau Kelvin). Kapasitas kalor dinyatakan dalam satuan energi per perubahan suhu (J/°C atau J/K).
Contoh Soal dan Pembahasan
Berikut adalah beberapa contoh soal mengenai kalor.
Soal 1
Sebuah bejana berisi 500 gram air pada suhu 20°C. Jika kalor jenis air adalah 4,18 J/g°C, berapa kalor yang diperlukan untuk meningkatkan suhu air menjadi 40°C?
Diketahui:
m air = 500 gram
ΔT = 40°C – 20°C = 20°C
c = 4,18 J/g°C
Jawaban:
Q = m.c.ΔT
Q = 500 g . 4,18 J/g°C . 20°C
Q = 41800 J
Q = 41,8 kJ
Soal 2
Berapa kapasitas kalor air dengan massa 5 kg dan kalor jenis 4200 J/kg°C?
Diketahui:
m = 5 kg
c = 4200 J/kg°C
Jawaban:
C = m.c
C = 5 kg . 4200 J/kg°C
C = 21000 J/°C
Sudah Paham tentang Apa Itu Kalor?
Kalor adalah perpindahan energi panas pada dua benda yang mempunyai perbedaan suhu. Pemahaman tentang kalor dan transfer panas penting dalam berbagai aplikasi teknologi, pengaturan suhu, dan pemahaman tentang efek perubahan suhu terhadap materi dan sistem.
Pengaturan dan transfer kalor berperan penting dalam proses-proses alami dan buatan, serta dalam berbagai aplikasi di bidang industri dan ilmiah. Semoga penjelasan di atas bermanfaat!

