Larutnya gula dalam air merupakan salah satu contoh aplikasi peristiwa laju reaksi. Kecepatan laju reaksi bergantung pada beberapa faktor yang mempengaruhinya. Lalu, apa saja faktor yang mempengaruhi laju reaksi? Mari kita kupas satu-persatu.
Pengertian Laju Reaksi
Pada reaksi kimia, reaktan akan bereaksi untuk membentuk produk. Dengan demikian, reaktan akan berkurang, sedangkan produk akan bertambah. Perubahan konsentrasi reaktan atau hasil reaksi dibandingkan dengan banyaknya waktu yang dibutuhkan untuk bereaksi itulah yang disebut dengan laju reaksi.
Secara matematis, laju reaksi adalah perubahan konsentrasi terhadap perubahan waktu. Perubahan tersebut dapat berupa penambahan atau pengurangan tergantung reaksi yang terjadi. Laju reaksi dapat dirumuskan sebagai berikut:
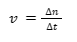
di mana:
v = laju reaksi atau kecepatan reaksi (mol/s).
Δn = perubahan mol (mol).
Δt = perubahan waktu (s).
Dalam kehidupan sehari-hari, kita seringkali menemukan reaksi kimia yang berlangsung dengan cepat ataupun lambat. Seperti nyala kembang api contohnya. Kita semua tahu bahwa perubahan reaksi pada kembang api terjadi sangat cepat.
Lalu, bagaimana dengan perubahan yang sangat lambat? Apakah ada perubahan zat kimia yang lambat di sekitar kita?
Tentu ada. Seperti besi yang berkarat dan kamar mandi yang berkerak. Itu tadi adalah contoh-contoh laju reaksi yang berlangsung dengan cepat maupun lambat.
Faktor yang Mempengaruhi Laju Reaksi dan Contohnya
Dari contoh-contoh yang telah kita bahas sebelumnya, peristiwa laju reaksi memiliki kecepatan yang berbeda-beda. Perbedaan perubahan laju reaksi tersebut dipengaruhi oleh beberapa faktor. Faktor yang mempengaruhi laju reaksi antara lain:
1. Konsentrasi
Konsentrasi merupakan banyaknya partikel yang terdapat pada suatu senyawa per-satuan volume. Suatu larutan dengan konsentrasi tinggi tentu mengandung partikel-partikel yang lebih rapat daripada dengan konsentrasi larutan yang rendah.
Kerapatan partikel ini dapat menyebabkan semakin besarnya kemungkinan terjadi tumbukan antar partikel yang menjadikan semakin tinggi pula laju reaksinya. Semakin banyak tumbukan yang terjadi akan lebih memungkinkan untuk menghasilkan tumbukan efektif yang semakin besar, sehingga reaksinya berlangsung cepat.
Contoh dari pengaruh konsentrasi terhadap laju reaksi adalah saat kita melarutkan gula dalam air. Semakin banyak gula yang dimasukkan ke dalam air, maka laju reaksi yang akan terjadi menjadi semakin cepat. Sebaliknya jika konsentrasi kecil, maka laju reaksinya juga lambat karena sedikitnya partikel yang bertumbukan.
2. Luas Permukaan
Faktor yang mempengaruhi laju reaksi selanjutnya yaitu luas permukaan. Luas permukaan menjadi faktor berpengaruh dalam laju reaksi pada reaksi dengan reaktan bentuk padat. Benda padat dengan massa yang sama dan berukuran kecil memiliki luas permukaan lebih besar daripada benda berukuran lebih besar.
Laju reaksi yang terjadi pada suatu materi yang memiliki luas permukaan lebih besar akan lebih cepat daripada dengan suatu materi yang luas permukaannya lebih kecil. Hal ini terjadi juga karena luas permukaan sentuh yang lebih banyak menyebabkan semakin tingginya kemungkinan partikel untuk bertumbukan.
Contoh laju reaksi yang dipengaruhi oleh faktor luas permukaan adalah saat melarutkan suplemen dalam air. Suplemen yang memiliki bentuk kepingan padat akan membutuhkan waktu lebih lama daripada suplemen dengan bentuk serbuk. Hal ini karena suplemen berbentuk bubuk memiliki luas permukaan yang lebih besar.
3. Suhu
Faktor yang mempengaruhi laju reaksi berikutnya adalah suhu. Suhu atau temperatur ternyata juga mempengaruhi besarnya energi potensial suatu zat. Zat-zat yang memiliki energi potensial kecil, jika bertumbukan akan sukar menghasilkan tumbukan efektif.
Hal ini terjadi karena zat-zat tersebut tidak mampu melampaui energi aktivasi. Dengan menaikkan suhu, maka hal itu akan memperbesar energi potensial sehingga ketika bertumbukan akan menghasilkan reaksi.
Dengan menaikkan temperatur, kecepatan gerak partikel menjadi lebih tinggi, lalu energi gerak atau energi kinetik partikel bertambah sehingga tumbukan sering terjadi. Frekuensi tumbukan yang semakin besar menyebabkan kemungkinan terjadinya tumbukan efektif dan mampu menghasilkan laju yang semakin cepat.
Contoh yang dapat dan sering kita temui adalah saat melarutkan air dalam air. Cara melarutkan menggunakan suhu tinggi akan mempercepat laju reaksi yang terjadi. Oleh karena itu, gula yang larut dalam air yang panas dan air yang dingin memiliki perbedaan pada laju reaksinya.
4. Katalis
Faktor yang mempengaruhi laju reaksi berikutnya adalah katalis. Katalis adalah zat yang mempengaruhi laju reaksi tanpa adanya perubahan yang kekal. Suatu katalis dapat terlibat dalam proses reaksi atau mengalami perubahan saat reaksi berlangsung. Namun, setelah reaksi selesai, maka katalis akan kembali seperti semula.
Apabila katalis tersebut mempercepat laju reaksi, maka dikenal dengan istilah katalisator. Namun, apabila katalis tersebut memperlambat laju suatu reaksi maka disebut dengan inhibitor atau katalis negatif.
Tidak semua laju reaksi diharapkan menjadi laju reaksi yang cepat. Pada beberapa hal, reaksi diharapkan memiliki laju reaksi yang lambat. Contohnya pada reaksi yang merugikan. Pada reaksi-reaksi yang merugikan diharapkan reaksi memiliki laju yang lambat seperti pembusukan pada makanan atau terjadinya perkaratan pada logam.
Berdasarkan wujud dan fasenya, katalis dibedakan menjadi katalis homogen dan katalis heterogen. Katalis homogen adalah apabila wujud katalis tersebut sama dengan wujud zat pereaksinya. Sebaliknya, apabila fase zat katalis berbeda dengan zat pereaksinya, maka disebut dengan katalis heterogen.
Bagaimana prinsip kerja katalis dalam suatu reaksi? Katalis dapat mempercepat laju reaksi karena katalis menyediakan alternatif jalur reaksi dengan energi aktivasi yang lebih rendah daripada jalur reaksi tanpa katalis, sehingga reaksinya menjadi semakin cepat.
Contoh katalis sebagai faktor yang mempengaruhi laju reaksi adalah pengkarbitan buah. Karbit (CaC2) atau kalsium karbida ini biasanya disemprotkan atau disuntikkan pada buah yang belum matang untuk mempercepat makanan.
Teori Tumbukan
Max Trautz dan William Lewis adalah ilmuwan yang pertama kali mengembangkan teori tumbukan pada awal abad ke-20. Teori tumbukan identik dengan laju reaksi yang merupakan tumbukan yang terjadi saat reaksi dalam suatu zat sedang berlangsung.
Tumbukan antar satu partikel lain akan menjadikan suatu reaksi terjadi. Akan tetapi, tidak semua partikel yang bertumbukan menghasilkan reaksi kimia karena setiap molekul memiliki energi kinetik yang berbeda. Jika energi kinetik besar, maka tumbukan yang terjadi akan keras dan mampu untuk memutus ikatan kimia.
Keadaan tersebut dinamakan keadaan teraktivasi. Reaktan membutuhkan energi untuk mencapai keadaan teraktivasi yang disebut energi aktivasi. Sedangkan dari energi teraktivasi menuju ke produk yang terjadi adalah pelepasan energi.
Teori tumbukan seringkali digunakan untuk menjelaskan tentang pengaruh apa saja yang menjadi faktor yang mempengaruhi laju reaksi. Adanya tumbukan antar partikel menandakan bahwa reaksi terus terjadi. Itulah mengapa laju reaksi dapat dilihat dari seberapa cepat reaksi tersebut yang terjadi.
Persamaan Laju Reaksi
Persamaan laju reaksi adalah cara untuk menggambarkan bagaimana laju atau kecepatan suatu reaksi kimia berubah seiring waktu. Persamaan laju reaksi dapat dituliskan sebagai berikut:
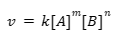
di mana:
v = laju reaksi (M/s)
k = konstanta laju reaksi
[A] = konsentrasi reaktan A (M)
[B] = konsentrasi reaktan B (M)
m = orde reaksi terhadap reaktan A
n = orde reaksi terhadap reaktan B
Orde Reaksi
Orde reaksi yaitu pangkat dari konsentrasi reaktan yang menunjukkan perubahan konsentrasi terhadap perubahan laju reaksi. Terdapat tiga jenis orde reaksi dalam laju reaksi, antara lain:
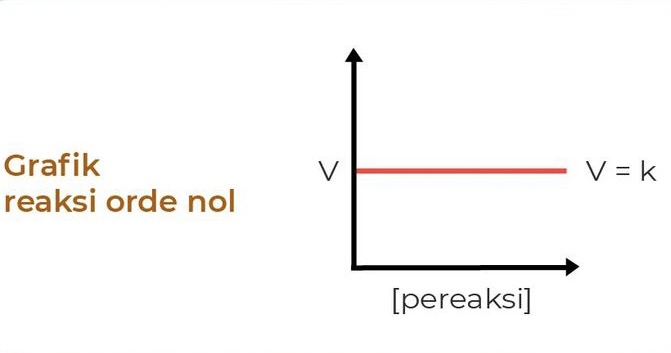
1. Orde Reaksi 0
Pada reaksi yang memiliki orde 0, laju reaksi tidak dipengaruhi oleh konsentrasi reaktan, sehingga laju reaksi akan memiliki besar yang sama dengan tetapan laju reaksi (k). Persamaan laju reaksi dengan orde 0 yaitu:
V = k
di mana V adalah laju reaksi dan k adalah konstanta laju reaksi.
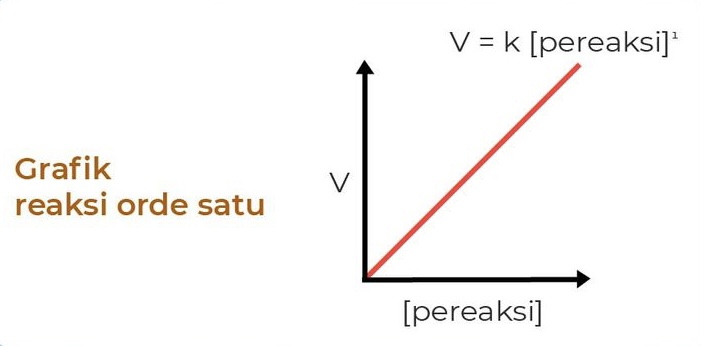
2. Orde Reaksi 1
Laju reaksi dengan orde 1 memiliki laju yang berbanding lurus dengan konsentrasi pereaksi. Sehingga, jika konsentrasi pereaksi naik dua kali lipat, maka laju reaksi juga naik dua kali lipat. Persamaan laju reaksi orde 1 yaitu:
V = k [A]
di mana V adalah laju reaksi, k adalah konstanta laju reaksi, dan [A] adalah konsentrasi reaktan.
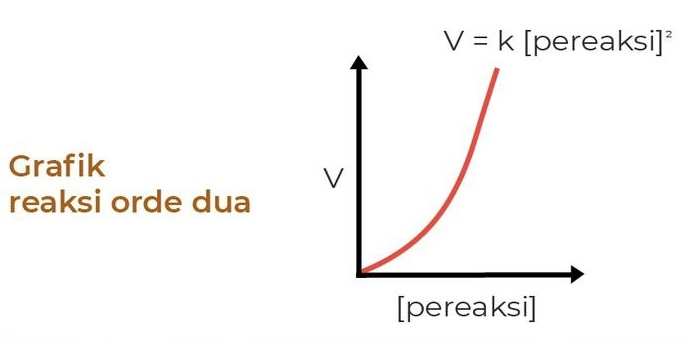
3. Orde Reaksi 2
Pada orde 2, jika konsentrasi naik sebanyak n kali, maka laju reaksinya naik sebanyak n pangkat 2 kali. Persamaan laju reaksi orde 2 yaitu:
V = k [A]²
di mana V adalah laju reaksi, k adalah konstanta laju reaksi, dan [A] adalah konsentrasi pereaksi.
Sudah Paham tentang Laju Reaksi?
Laju reaksi adalah perubahan konsentrasi atau hasil reaksi dalam suatu satuan waktu. Banyak faktor yang mempengaruhi laju reaksi dan sering kita temui sehari-hari. Dengan memperhatikan faktor-faktor tersebut, kita dapat mengatur laju reaksi sesuai dengan keinginan dan kebutuhan saat mereaksikan suatu zat.

