Elektrolisis adalah salah satu proses kimia penting yang memungkinkan kita memisahkan senyawa menjadi unsur-unsur penyusunnya melalui penggunaan arus listrik. Namun, bagaimana ya, cara kerjanya? Agar dapat menjawabnya, maka simak penjelasan mengenai cara kerja elektrolisis, termasuk juga reaksinya di sini!
Daftar ISI
Pengertian Elektrolisis dan Cara Kerjanya
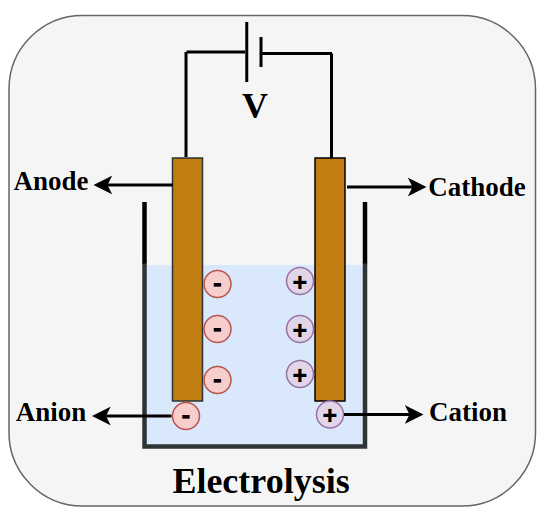
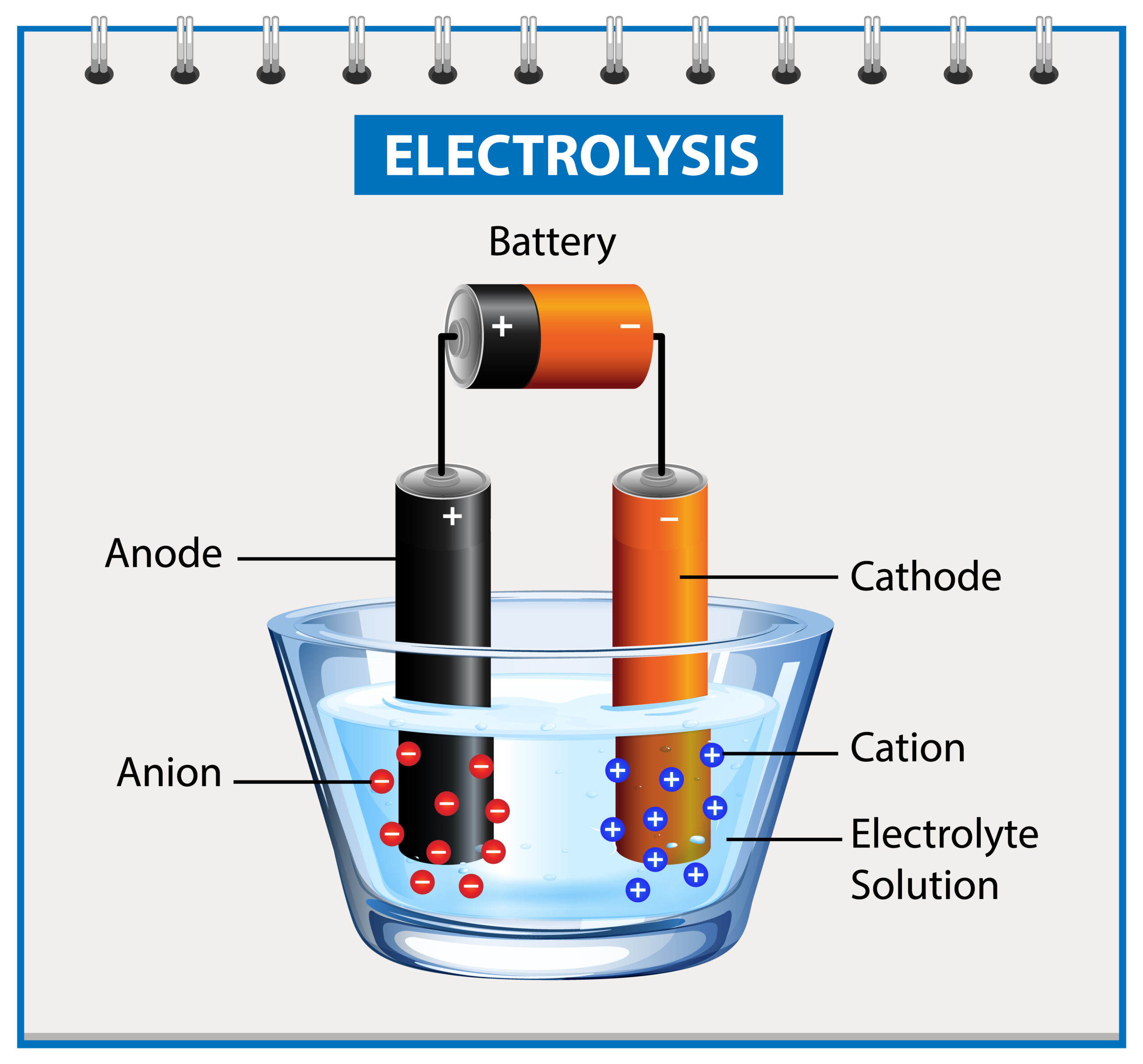
Proses kimia ini terjadi dalam sebuah alat yang disebut sel elektrolisis yang dicelupkan dalam larutan elektrolit. Larutan elektrolit ini mengandung ion-ion yang dapat bergerak. Sementara itu, jumlah elektroda biasanya ada 2, yaitu katode dan anode.
Prinsip dasar proses tersebut adalah menggunakan arus listrik untuk menghasilkan pergerakan ion-ion dalam larutan elektrolit agar bergerak menuju elektroda dengan muatan berlawanan. Berkat arus listrik, maka reaksi kimia mungkin untuk terjadi di elektroda dan menghasilkan perubahan kimia yang diinginkan.
Apa yang Dimaksud dengan Katode dan Anode?
1. Katode
Di dalam sel elektrolisis, katode adalah elektroda negatif. Oleh karena itu, ion-ion positif dalam larutan elektrolit akan menuju katode dan menerima elektron dari arus listrik, lalu mengalami reduksi menjadi zat yang tereduksi.
2. Anode
Sedangkan elektroda positif dalam sel elektrolisis adalah anode. Jadi, yang berjalan menuju anode adalah ion-ion negatif dalam larutan elektrolit. Kemudian, ion-ion tersebut akan melepaskan elektron ke arus listrik, lalu mengalami oksidasi menjadi zat yang teroksidasi.
Kedua proses ini memungkinkan senyawa dalam larutan elektrolit untuk terurai menjadi unsur-unsur penyusunnya di katode dan anode.
Lantaran proses elektrolisis memerlukan pergerakan ion dari penggunaan listrik, maka dari itu penting untuk menggunakan larutan elektrolit yang mengandung ion-ion yang dapat bergerak. Lalu, ion-ion tersebut akan memungkinkan arus listrik untuk mengalir sehingga reaksi kimia terjadi.
Hasil dari elektrolisis dapat berupa unsur-unsur murni atau senyawa baru tergantung pada jenis senyawa yang digunakan sebagai larutan elektrolit.
2 Jenis Elektroda dalam Sel Elektrolisis
Dua pilihan utama elektroda dalam sel elektrolisis adalah elektroda inert dan elektroda aktif.
1. Elektroda Inert
Pertama, elektroda yang tidak bereaksi secara kimia selama proses elektrolisis adalah elektroda inert. Elektroda jenis ini tidak hanya memiliki fungsi sebagai penghantar arus listrik, tetapi juga memungkinkan terjadinya reaksi kimia tanpa harus terlibat dalam reaksi tersebut.
Biasanya, elektoda inert terbuat dari logam yang inert atau tidak bereaksi secara kimia, contohnya adalah platina atau grafit. Oleh karena itu, penggunaan elektroda inert memberikan kontrol yang lebih baik terhadap reaksi elektrolisis karena elektroda itu sendiri tidak berubah selama proses tersebut.
2. Elektroda Aktif
Sementara itu, elektroda aktif adalah elektroda yang bereaksi secara kimia selama proses elektrolisis. Jadi, mereka ikut terlibat dalam reaksi redoks dan mengalami perubahan kimia. Contoh elektroda aktif antara lain adalah elektroda tembaga (Cu) dan elektroda seng (Zn).
Berdasarkan perbedaan tersebut, pemilihan jenis elektroda sangat tergantung pada tujuan dari proses elektrolisis dan sifat kimia senyawa yang diolah. Elektroda inert digunakan jika kita ingin menghindari pencemaran senyawa oleh elektroda, atau jika ingin mengontrol reaksi dengan lebih akurat.
Sementara itu, lantaran sifatnya yang ikut bereaksi, maka penggunaan elektroda aktif dalam elektrolisis adalah ketika kita ingin menghasilkan logam atau senyawa tertentu secara selektif.
2 Reaksi Utama yang Terjadi pada Sel Elektrolisis dan Rumusnya
Ada dua bagian utama reaksi pada sel elektrolisis, yaitu reaksi yang terjadi pada katode dan reaksi yang terjadi pada anode. Berikut adalah penjelasan lengkapnya.
1. Reaksi pada Katode: Reduksi
Pada katode, ion-ion positif dalam larutan elektrolit menerima elektron dari elektroda dan mengalami reduksi. Reduksi pada elektrolisis adalah proses di mana suatu zat mendapatkan elektron. Karena mendapatkan elektron, maka zat tersebut mengalami penurunan bilangan oksidasi.
Rumus umum reaksi pada katode adalah:
An+ + ne− → A
Di mana:
- An+ adalah ion positif dalam larutan elektrolit yang akan direduksi,
- n adalah jumlah elektron yang diterima oleh ion tersebut selama reaksi,
- A adalah unsur atau senyawa yang dihasilkan setelah reduksi.
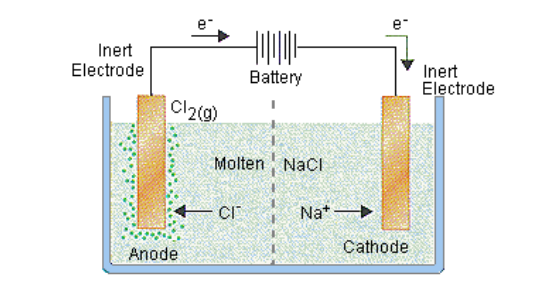
Misalnya, kita menggunakan contoh elektrolisis larutan natrium klorida (NaCl). Pada katode, ion natrium (Na+) mengalami reaksi dengan menerima satu elektron dan berubah menjadi natrium (Na):
Na+ +e− → Na
2. Reaksi pada Anode: Oksidasi
Sedangkan pada anode sel elektrolisis, reaksi yang terjadi adalah oksidasi, di mana ion-ion negatif dalam larutan elektrolit melepaskan elektron ke elektroda.
Sementara itu, oksidasi adalah proses di mana suatu zat kehilangan elektron dan mengalami peningkatan bilangan oksidasi.
Rumus umum reaksi pada anode adalah:
B → Bm− + me−
Di mana:
- B adalah unsur dalam larutan elektrolit yang akan teroksidasi,
- Bm− adalah ion negatif yang dihasilkan setelah oksidasi,
- m adalah jumlah elektron yang dilepaskan oleh ion tersebut selama reaksi.
Jika kita masih menggunakan contoh elektrolisis larutan natrium klorida (NaCl), maka pada anodenya, yang mengalami reaksi oksidasi adalah ion klorida (Cl-) menjadi gas klorin (Cl2):
2Cl− → Cl2 +2e−
Jadi, hasil elektrolisis NaCl adalah gas klorin yang dapat terlihat keluar dari larutan elektrolit.
Adakah Aturan Reaksi pada Elektrolisis?
Reaksi-reaksi kimia pada kedua elektroda, yaitu katode (elektroda negatif) dan anode (elektroda positif), berlangsung sebagaimana pada penjelasan di atas. Namun, ada aturan-aturan tambahan berikut ini yang menjadi panduan reaksi pada elektroda-elektroda tersebut.
1. Aturan Katode
a. Reduksi Berlangsung pada Katode
Pada elektroda katode, reaksi kimia yang dominan adalah reduksi. Jadi, anoda bermuatan negatif akan menarik ion-ion positif dan mendonorkan elektronnya.
b. Unsur atau Ion dengan Potensial Reduksi Lebih Rendah Akan Tereduksi Terlebih Dahulu
Kemudian, jika larutan elektrolit mengandung beberapa jenis ion yang dapat direduksi, maka ion dengan potensial reduksi lebih rendah akan tereduksi terlebih dahulu, karena lebih cenderung menerima elektron.
Potensial reduksi adalah ukuran kemudahan suatu zat untuk mengalami reduksi. Oleh sebab itu, ion-ion dengan kemampuan reduksi lebih tinggi akan tetap berada dalam bentuk ion dalam larutan hingga ion dengan potensial reduksi lebih rendah telah direduksi.
c. Aturan Lain
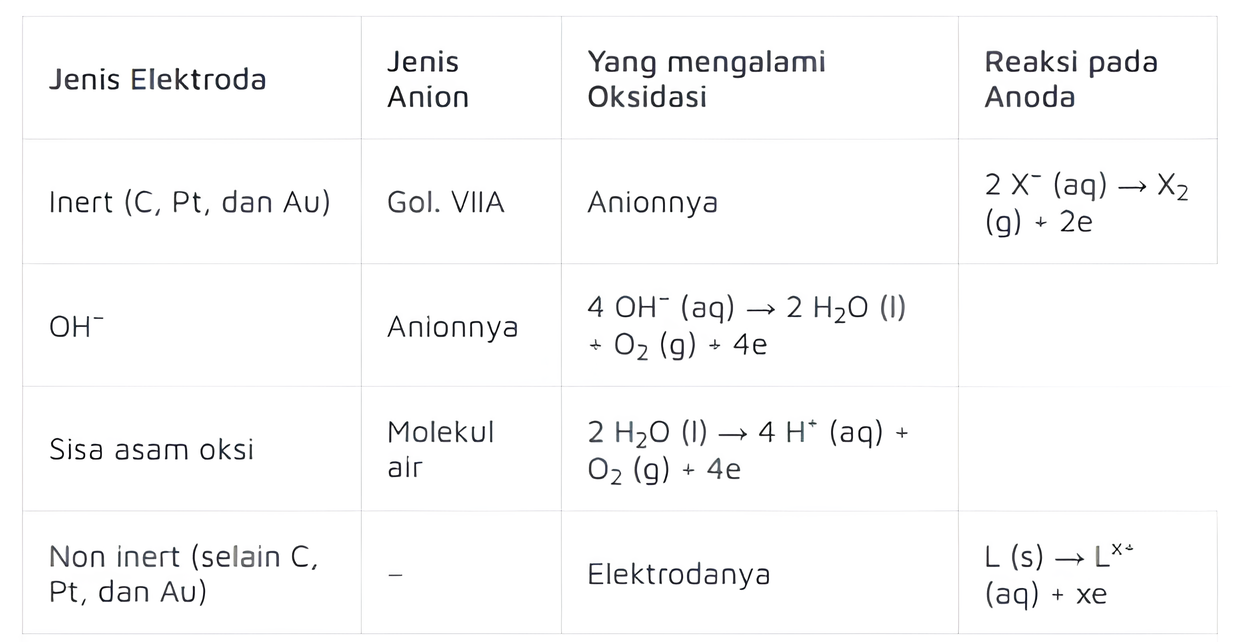
Selain itu, terdapat aturan-aturan lainnya yang dirangkum pada tabel berikut:

2. Aturan Anode
a. Oksidasi Terjadi pada Anode
Pada elektroda anode reaksi kimia yang dominan adalah oksidasi. Jadi, anode menarik ion negatif karena anode adalah elektroda positif.
b. Unsur atau Ion dengan Potensial Oksidasi Lebih Rendah Akan Dioksidasi Terlebih Dahulu
Jika larutan elektrolit mengandung beberapa jenis ion yang dapat dioksidasi, maka ion dengan potensial oksidasi lebih rendah (yaitu lebih cenderung melepaskan elektron) akan dioksidasi terlebih dahulu.
Potensial oksidasi adalah ukuran kemampuan suatu zat untuk mengalami oksidasi. Oleh karena itu, ion-ion dengan kemampuan oksidasi lebih tinggi akan tetap berada dalam bentuk ion dalam larutan hingga ion dengan potensial oksidasi lebih rendah telah dioksidasi.
c. Aturan Lainnya
Sama seperti pada katode, reaksi pada anode juga memiliki aturan lain selain yang telah dijelaskan di atas. Apa saja? Perhatikan tabel di bawah ini.
Baca Juga: 7 Perbedaan Sel Volta dan Sel Elektrolisis Beserta Contohnya
Contoh Soal dan Pembahasan
Yuk, simak contoh soal beserta pembahasannya di bawah ini supaya kamu makin paham tentang reaksi elektrolisis di dalam elektroda!
Contoh Soal
Sebuah sel elektrolisis menggunakan larutan elektrolit tembaga sulfat (CuSO4). Elektroda dari sel elektrolisis tersebut adalah Pt yang bersifat inert. Jika arus listrik dialirkan melalui sel ini, apa yang akan terjadi pada elektroda katode dan anode?
Pembahasan
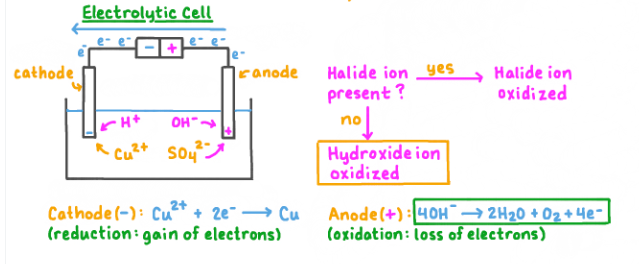
CuSO4 akan larut membentuk ion-ion di dalam air menjadi:
CuSO4 → Cu2+ + SO4 2-
Air juga akan pecah menjadi ion-ion:
H2O → H+ + OH–
Pada katode, ion tembaga (Cu2+) akan direduksi menjadi tembaga (Cu). Reaksinya adalah:
Cu2+ +2e− → Cu
Sedangkan pada anode, yang mengalami oksidasi adalah ion hidroksida (OH–) dari pecahan air, lalu menjadi oksigen (O2) dan air (H2O). Kemudian akan bereaksi menjadi:
4OH− → O2 + 2H2O + 4e−
Apa Faktor Utama Pembentuk Proses Kimia yang Satu Ini?
Karena elektrolisis penting dalam berbagai proses yang memerlukan pemisahan senyawa menjadi unsur-unsurnya melalui penggunaan arus listrik, maka kita perlu memiliki pemahaman yang komprehensif tentang materi ini. Termasuk yang paling penting yaitu aturan-aturan reaksi pada masing-maisng elektrodanya.
Berdasarkan ulasan di atas, kamu dapat melihat bahwa faktor utama dalam elektrolisis adalah adanya arus listrik pada kedua elektrode. Di samping itu, ada pula berbagai aturan yang memberikan panduan tentang bagaimana reaksi-reaksi elektrolisis terjadi pada katode dan anode.
Yakni, reaksinya adalah tergantung pada jenis ion dan zat yang terlibat dalam proses elektrolisis. Selain itu, ingat bahwa perpindahan ion-ion di dalam larutan elektrolit selalu menuju anoda yang memiliki muatan berlawanan sehingga mereka bisa saling tarik menarik.