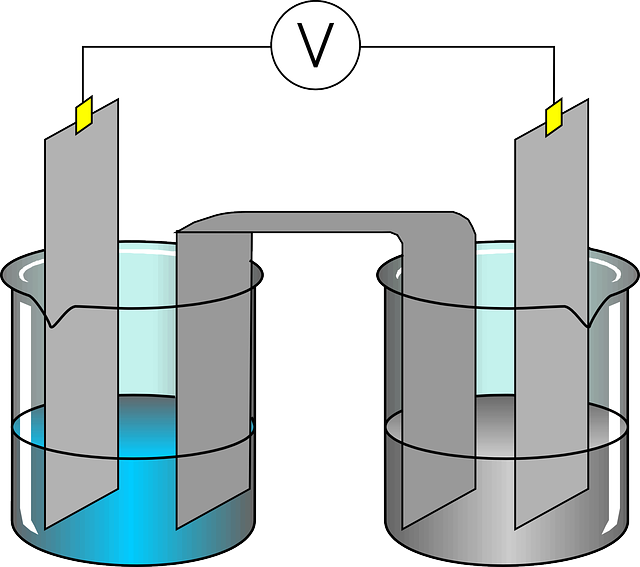
Salah satu perbedaan larutan elektrolit dan non elektrolit yang mendasar adalah kemampuan menghantarkan listrik. Singkatnya, kedua jenis larutan tersebut diklasifikasikan berdasarkan sifat konduktif dan non konduktifnya terhadap suatu larutan.
Yuk, pelajari info lengkap tentang jenis larutan terhadap daya listrik di artikel ini!
Daftar ISI
- Apa Itu Larutan Elektrolit dan NonElektrolit?
- Ada 6 Perbedaan Larutan Elektrolit dan NonElektrolit yang Utama!
- Cara Mengkategorikan Perbedaan Larutan Elektrolit dan NonElektrolit
- Contoh Senyawa Elektrolit dan NonElektrolit
- Apa saja Faktor yang Memengaruhi Sifat Elektrolit?
- Ilustrasi Peran Elektrolit dalam Tubuh
- Apakah Penting Mengenal Perbedaan Larutan Elektrolit dan NonElektrolit?
Apa Itu Larutan Elektrolit dan NonElektrolit?
Agar kamu bisa mengidentifikasi berbagai perbedaan larutan elektrolit dan nonelektrolit dengan lebih baik, sebaiknya pahami dulu penjelasan dasar tentang larutan elektrolit dan nonelektrolit berikut ini.
1. Elektrolit
Suatu senyawa apabila dilarutkan dalam suatu pelarut dan menghasilkan larutan yang bersifat elektrik, maka hasilnya adalah elektrolit. Ketika larutan elektrolit terlarut pada suatu pelarut, maka dia akan terdisosiasi menjadi ion dan menghantarkan listrik.
Supaya larutan elektrolit bisa larut menjadi ion-ionnya, maka larutan tersebut harus berupa senyawa ionik. Senyawa ionik tersusun dari kation dan anion. Ion-ion tersebut tersebar merata di seluruh larutan. Jika arus listrik diberikan ke larutan elektrolit, maka ion-ion dalam larutan akan bergerak.
Kation atau ion positif akan bergerak ke elektroda yang memiliki kerapatan elektron tinggi (katoda). Sedangkan, anion atau ion negatif cenderung bergerak ke elektroda lain (anoda). Gerakan ion-ion menuju elektrodanya masing-masing tersebut akhirnya menghasilkan aliran arus listrik dalam larutan, sehingga bersifat konduktif.
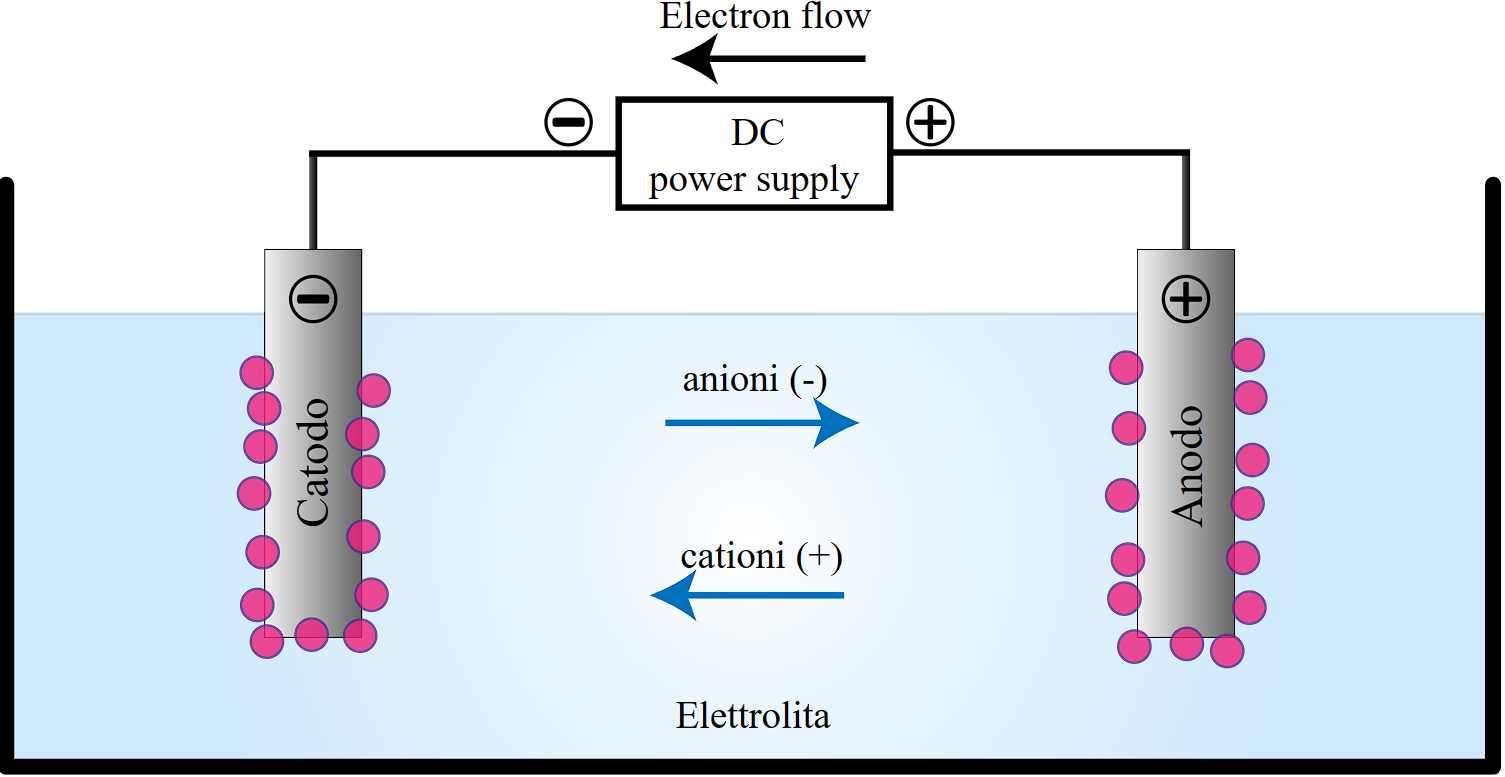
Jenis-jenis larutan elektrolit terbagi menjadi dua, yaitu elektrolit kuat dan elektrolit lemah.
a) Elektrolit kuat
Jenis larutan elektrolit ini sepenuhnya terionisasi menjadi ion-ionnya. Pada elektrolit kuat tidak ada molekul netral. Namun, bukan berarti semua bahan kimia pada larutan elektrolit kuat akan larut dalam air.
Prinsip elektrolit kuat adalah walaupun tidak terlalu banyak yang terlarut, akan tetapi semua yang terlarut pecah menjadi ion. Contohnya, basa kuat stronsium hidroksida (Sr(OH)₂) yang memiliki kelarutan rendah dalam air, tetapi terdisosiasi sepenuhnya menjadi ion Sr²⁺ dan OH⁻.
Persamaan yang melibatkan ionisasi elektrolit dapat diwakilkan dengan panah irreversible atau tidak bolak balik. Panah tersebut menunjukkan bahwa reaksi benar-benar sepenuhnya terionisasi menjadi ion-ion. Persamaan reaksi kimianya, seperti berikut ini:
HCl + H2O → H3O+ + Cl–
HNO3 + H2O → H3O+ + NO3–
b) Elektrolit lemah
Tipe elektrolit lemah tidak sepenuhnya terionisasi menjadi ion-ionnya sehingga, ada beberapa molekul netral dalam larutan. Pada praktiknya, larutan elektrolit lemah hanya sekitar 1% hingga 10% yang terionisasi menjadi ion-ion.
Panah persamaan reaksi kimia pada elektrolit lemah adalah reversible atau dapat bolak-balik. Arti panah tersebut menunjukkan hanya sebagian kecil yang terionisasi.
NH3 + H2O → NH4+ + OH–
CH3COOH + H2O → H3O+ + CH3COO–
2. Non Elektrolit
Non elektrolit adalah zat yang tidak pernah terionisasi sepenuhnya ketika terlarut dalam air. Artinya, ionisasi lengkap tidak akan terjadi ketika zat-zat kimia bercampur dengan pelarut sehingga, larutan non elektrolit tidak memiliki sifat konduktif.
Tidak seperti elektrolit, jika larutan non elektrolit dilarutkan dalam air maka, akan menyebabkan kation dan anion tidak dapat terpisah. Larutan non elektrolit adalah senyawa kovalen karena tidak membentuk ion sama sekali.
Ada 6 Perbedaan Larutan Elektrolit dan NonElektrolit yang Utama!
Mengikuti penjelasan dari masing-masing jenis larutan di atas, kamu bisa mengenal enam perbedaan antara keduanya melalui perincian di bawah ini.
1. Konduktivitas Listrik
Dalam daya hantar listrik, elektrolit bertindak sebagai konduktor listrik dalam suatu larutan atau dapat menghantarkan listrik. Sebaliknya, non elektrolit tidak pernah memiliki karakteristik sebagai konduktor atau tidak dapat menghantarkan listrik.
2. Produksi Ion
Ketika terlarut dalam pelarut, larutan elektrolit benar-benar bisa terurai menjadi ion, yaitu terpisah sebagai kation dan anion. Lain halnya dengan larutan non elektrolit, ketika terlarut dalam pelarut, dia tidak pernah sepenuhnya terurai menjadi ion.
3. Ikatan Kimia
Ikatan antara senyawa yang membentuk elektrolit bersifat ionik. Namun, umumnya non elektrolit memiliki ikatan kovalen antar molekul.
4. Polaritas
Adanya muatan positif dan negatif dalam elektrolit (perbedaan elektronegativitasnya antara 0,3 hingga 1,4) maka, larutan ini terkonfigurasi sebagai senyawa polar.
Sementara itu, larutan elektrolit tidak punya perbedaan yang signifikan pada elektronegativitas larutannya. Perbedaannya hanya sebesar 0 hingga 0,2 sehingga, terkonfigurasi sebagai senyawa non polar.
5. Senyawa Penyusun
Perbedaan larutan elektrolit dan non elektrolit lainnya adalah contoh senyawanya. Jika elektrolit berupa senyawa asam, basa, dan garam, senyawa non elektrolit contohnya adalah gula, lemak, dan senyawa yang mengandung karbon.
6. Pengelompokkan Jenis Larutan
Pengelompokkan elektrolit berdasarkan kadar kekuatannya (kuat dan lemah), sedangkan non elektrolit adalah larut dan tidak larut dalam air.
Cara Mengkategorikan Perbedaan Larutan Elektrolit dan NonElektrolit
Zat dapat masuk dalam kategori elektrolit kuat, elektrolit lemah, atau nonelektrolit dengan mempelajari konduktansi listriknya dalam larutan air. Larutannya akan menghantarkan listrik jika mengandung ion bebas dan bermuatan.
Catatan pentingnya adalah bahwa konduktivitas larutan elektrolit terkait dengan kekuatan elektrolit. Maka, makin besar konsentrasi ionik larutan yang ada, akan makin besar konduksi.
Jadi, setelah menerapkan tegangan pada elektroda yang direndam dalam larutan, Anda harus mengetahui konsentrasi ionik secara kuantitatif. Caranya adalah dengan mengukur arus listrik, atau dengan mengamati kecerahan bola lampu yang termasuk dalam rangkaian.
Makin cerah warna lampu, maka akan menunjukkan bahwa larutan tersebut termasuk elektrolit kuat. Cahaya lampu yang kurang terang, berarti larutannya adalah elektrolit lemah. Apabila lampu sama sekali tidak menyala, artinya larutan tersebut adalah non elektrolit.
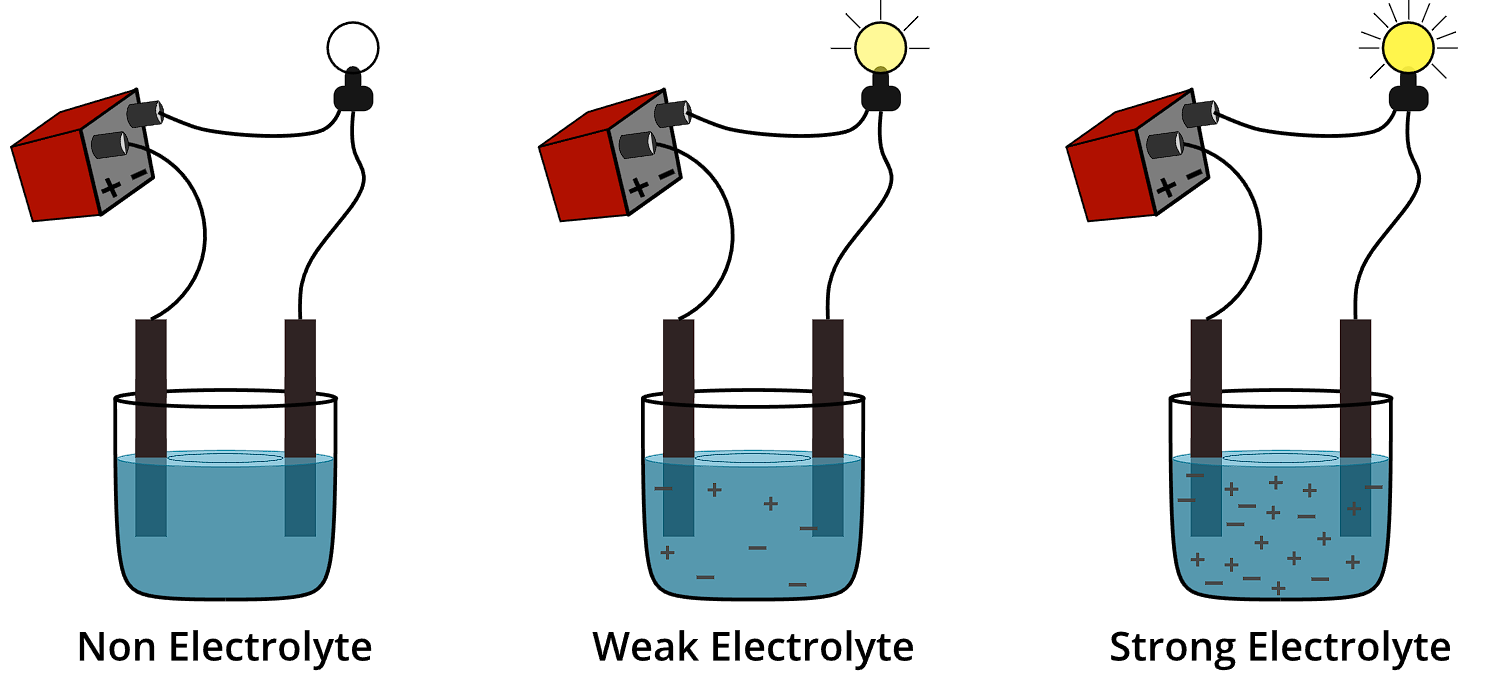
Contoh Senyawa Elektrolit dan NonElektrolit
Ada beberapa contoh jenis zat dan senyawa yang dapat menunjukkan perbedaan larutan elektrolit dan non elektrolit secara jelas.
1. Larutan Elektrolit
Asam kuat, basa kuat, termasuk elektrolit kuat.
Zat-zat yang termasuk elektrolit kuat antara lain adalah:
- asam klorida (HCl),
- asam sulfat (H₂SO₄),
- asam bromida (HBr),
- asam hidroiodik (HI),
- natrium hidroksida (NaOH),
- kalium hidroksida (KOH),
- natrium asetat (CH₃COONa) dan
- natrium klorida (NaCl).
Ciri yang dapat mudah Anda ingat yaitu asam lemah dan basa lemah termasuk sebagai elektrolit lemah. Contoh dari elektrolit lemah adalah asam fluorida (HF), kalsium hidroksida (Ca(OH)₂), asam asetat (CH₃COOH), asam etanadionat (H₂C₂O₄), piridin (C₅H₅N), perak klorida (AgCl), barium sulfat (BaSO₄), dan amonia (NH₃).
2. Contoh Larutan NonElektrolit
Karakteristik non elektrolit adalah tersusun atas senyawa yang mengandung karbon, lemak, dan gula. Contoh non elektrolit adalah glukosa (C₆H₁₂O₆), sukrosa (C₁₂H₂₂O₁₁), pentana (C₅H₁₂), etil alkohol (C₂H₅OH), kolesterol, air suling dan urea.
Zat-zat yang termasuk sebagai non elektrolit tidak memungkinkan adanya arus listrik mengalir karena tidak membentuk ion.
Apa saja Faktor yang Memengaruhi Sifat Elektrolit?
Kemampuan suatu senyawa untuk menjadi larutan elektrolit atau nonelektrolit tidak tergantung pada jenis senyawa itu sendiri, dan beberapa aspek penting yang dijelaskan dalam uraian berikut ini.
1. Kekuatan Asam atau Basa
Asam dan basa kuat lebih cenderung membentuk larutan elektrolit kuat karena mereka sepenuhnya terdisosiasi menjadi ion-ion. Sebaliknya, asam dan basa lemah cenderung kurang membentuk larutan elektrolit karena disosiasinya tidak sempurna sehingga termasuk dalam elektrolit lemah.
2. Konsentrasi
Konsentrasi zat dalam larutan juga memainkan peran penting dalam memengaruhi sifat elektrolit. Larutan elektrolit lemah pada konsentrasi yang rendah mungkin terasa sebagai larutan non-elektrolit.
3. Suhu
Suhu juga dapat memengaruhi sifat elektrolit suatu larutan. Pada suhu tinggi, beberapa senyawa yang biasanya tidak terdisosiasi menjadi ion-ion, memiliki kecenderungan menjadi lebih reaktif dan lebih cenderung untuk terdisosiasi.
Ilustrasi Peran Elektrolit dalam Tubuh
Ada banyak larutan elektrolit yang memiliki senyawa ionik, tetapi ada beberapa yang memainkan peran penting dalam tubuh. Pelajari contoh nyatanya berikut ini.
1. Kalsium (Ca)
Penting untuk gigi, kontraksi otot, pembekuan darah, dan fungsi saraf.
2. Sodium (Na)
Berperan dalam sel tubuh untuk menjaga keseimbangan air dan sinyal saraf tubuh.
3. Kalium (K)
Sebagai kation utama di dalam sel tubuh. Penting juga untuk berfungsinya jantung, otot, ginjal, dan saraf.
4. Magnesium (Mg)
Terlibat dalam tulang dan sel, otot, dan sistem saraf, serta terlibat dalam reaksi biokimia.
Baca Juga: Rumus Sifat Koligatif Larutan: 4 Jenisnya Beserta Contoh Soal
Apakah Penting Mengenal Perbedaan Larutan Elektrolit dan NonElektrolit?
Berdasarkan ulasan di atas, Anda dapat melihat bahwa perbedaan larutan elektrolit dan nonelektrolit utamanya terletak pada kemampuan larutan menghantarkan listrik.
Larutan elektrolit memiliki kemampuan untuk memecah diri menjadi ion-ion bermuatan, sementara larutan nonelektrolit tidak memiliki kemampuan tersebut ini dan tetap dalam bentuk molekul.
Di samping itu, Anda dapat melihat bahwa perbedaan tersebut nyatanya memiliki peran dan pengaruh yang berbeda dalam kehidupan manusia, contohnya seperti pada nutrisi untuk tubuh.