Dalam ilmu kimia, pemahaman tentang teori atom sangatlah penting. Atom merupakan unit dasar penyusun materi. Unit dasar ini memainkan peran krusial dalam menjelaskan sifat dan perilaku zat.
Dalam artikel ini, kita akan mempelajari teori atom, partikel penyusun, serta penjelasan lebih lanjut mengenai struktunya. Simak selengkapnya, ya! Selamat belajar!
Daftar ISI
Definisi Atom dan Penjelasannya
Atom adalah unit dasar atau partikel terkecil dari suatu unsur kimia yang masih mempertahankan sifat dan identitas kimianya.
Konsep ini pertama kali diajukan oleh para filsuf Yunani kuno, seperti Democritus dan Leucippus, yang mengusulkan bahwa materi terdiri dari partikel-partikel yang tidak dapat dibagi yang disebut “atomos”.
Menurut definisi dalam ilmu kimia modern, partikel terkecil ini terdiri dari inti atom yang mengandung proton dan neutron yang terikat bersama, serta elektron yang mengorbit inti dalam kulit atau orbital.
Partikel terkecil ini memiliki identitas yang unik berdasarkan jumlah proton di dalam inti atom. Jumlah proton ini menentukan unsur kimia yang terkait dengan atom tersebut. Misalnya, sebuah partikel terkecil dengan satu proton disebut hidrogen, atom dengan dua proton disebut helium, dan seterusnya.
Selain itu, atom juga memiliki massa yang ditentukan oleh jumlah proton dan neutron di dalam inti atom. Massa elektron jauh lebih kecil dibandingkan massa proton dan neutron sehingga diabaikan saat menghitung massa partikel terkecil ini.
Definisi ini menggambarkan bahwa sebuah partikel terkecil adalah entitas diskrit dan tidak dapat dibagi lagi menjadi partikel yang lebih kecil tanpa mengubah sifat dan identitas kimianya.
Namun, dengan kemajuan ilmu pengetahuan, eksperimen seperti pemecahan atom oleh reaksi nuklir dan penemuan partikel subatomik telah membuktikan bahwa partikel terkecil ini dapat terdiri dari partikel-partikel penyusun yang lebih kecil.
Pengertian Teori Atom dan Sejarah Awalnya
Teori atom adalah kerangka konseptual dalam kimia yang menjelaskan bahwa semua materi terdiri dari partikel kecil yang disebut atom. Konsep ini muncul sebagai respons terhadap pertanyaan tentang struktur dan sifat dasar materi.
Sama seperti definisi yang telah kami terangkan di atas, teori ini juga memandang partikel terkecil sebagai unit dasar yang tidak dapat dibagi lagi yang membentuk berbagai macam zat di alam.
Pemahaman tentang teori ini sangat penting dalam kimia karena atom adalah blok pembangun dari segala macam zat dan mempengaruhi sifat-sifat kimia, ikatan kimia, reaktivitas, dan berbagai fenomena kimia lainnya.
Dengan memahami struktur dan cara partikel-partikel penyusun saling berinteraksi, kita dapat menjelaskan berbagai fenomena kimia, merancang reaksi kimia, dan mengembangkan bahan-bahan baru dengan sifat-sifat yang diinginkan.
Sejarah Awal Teori Atom
Pengembangan teori partikel terkecil ini dimulai pada zaman kuno dengan kontribusi para filsuf dan ilmuwan terkenal. Salah satu tokoh yang memberikan kontribusi penting adalah Democritus, seorang filsuf Yunani kuno, yang mengajukan ide tentang keberadaan atom pada abad ke-5 SM.
Dia berpendapat bahwa materi dapat dipecah menjadi bagian yang lebih kecil hingga mencapai titik terkecil yang disebut atom, yang berarti “tidak dapat dipotong” dalam bahasa Yunani.
Namun, pengembangan teori yang lebih lengkap terjadi pada abad ke-19 dengan penemuan eksperimen-eksperimen yang mengungkapkan sifat partikel-partikel penyusun partikel terkecil ini. Salah satu percobaan yang terkenal adalah percobaan Rutherford yang dilakukan pada tahun 1911.
Selanjutnya, baca terus perkembangan teori yang akan dijelaskan satu per satu di bawah ini.
Apa Saja Teori Atom?
Dalam sejarah perkembangan ilmu kimia, terdapat beberapa teori atom yang diusulkan oleh para ilmuwan sebagai upaya untuk menjelaskan sifat dan struktur partikel terkecil ini. Perkembangan teori atom ini mencerminkan upaya para ilmuwan dalam memahami struktur dan sifat partikel-partikel penyusunnya.
Setiap teori memberikan kontribusi penting dalam memperluas pemahaman kita tentang partikel terkecil ini, dan teori-teori tersebut masih menjadi dasar dalam pemahaman modern tentang sifat dan struktur atom.
Berikut ini adalah beberapa teori yang penting dalam sejarah:
1. Teori Atom Dalton

Teori atom Dalton, yang diusulkan oleh John Dalton pada awal abad ke-19, adalah salah satu teori pertama yang disusun secara sistematis dalam ilmu kimia modern. Teori ini memberikan kontribusi yang signifikan dalam memahami struktur dan sifat dasar partikel terkecil ini.
Pada dasarnya, teori atom Dalton menyatakan bahwa:
- Atom merupakan partikel dasar yang tidak dapat dipecahkan lebih lanjut.
- Ia berasal dari unsur tertentu memiliki karakteristik yang sama, termasuk massa dan sifat kimia.
- Ia juga dapat bergabung membentuk senyawa dengan cara mengikat melalui perpaduan partikel terkecil yang proporsional.
Dalton percaya bahwa atom adalah bola kecil yang padat dan tidak dapat dipecahkan, seperti bola bilik dengan muatan positif yang merata dan elektron yang tersebar di dalamnya. Teori ini juga mengasumsikan bahwa setiap unsur memiliki partikel terkecil yang unik, yang membedakan satu unsur dari unsur lainnya.
Kontribusi utama teori atom Dalton terletak pada prinsip proporsi tetap dan hukum perbandingan berganda. Prinsip proporsi tetap menyatakan bahwa dalam suatu senyawa, unsur-unsur yang berbeda akan selalu bergabung dalam perbandingan bilangan bulat sederhana.
Sedangkan, hukum perbandingan berganda menyatakan bahwa jika dua unsur dapat membentuk lebih dari satu senyawa, rasio massa kedua unsur tersebut akan membentuk perbandingan bilangan bulat sederhana.
Keunggulan dan Kelemahan
Meskipun teori dari Dalton memberikan dasar penting dalam pemahaman struktur partikel terkecil, terdapat beberapa kelemahan yang kemudian ditemukan.
Misalnya, teori ini tidak dapat menjelaskan tentang subatomik, seperti proton, neutron, dan elektron, serta tidak dapat menjelaskan variasi massa partikel terkecil yang ditemukan dalam isotop.
Namun demikian, teori Dalton merupakan tonggak penting dalam sejarah perkembangan ilmu kimia dan menjadi pondasi bagi teori-teori atom selanjutnya yang lebih canggih dan akurat.
2. Teori Atom Thomson (Model Kue Kismis)
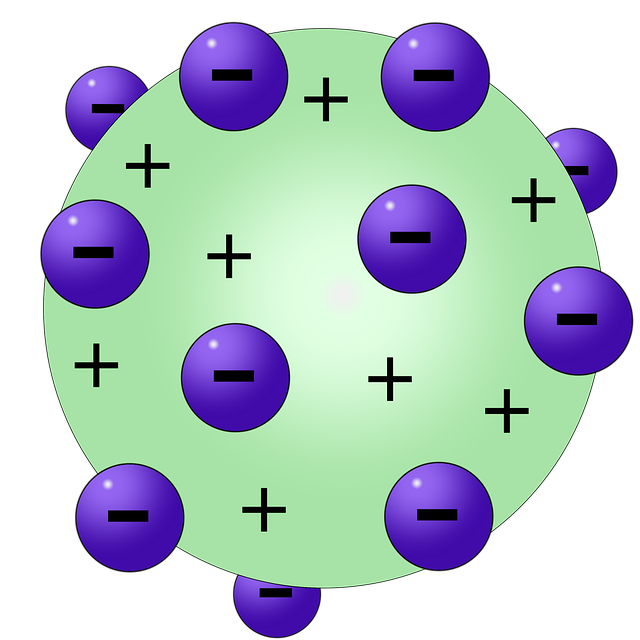
Model atom Thomson, yang diusulkan oleh J.J. Thomson pada tahun 1897, merupakan perkembangan penting dalam pemahaman struktur atom. Model ini menggambarkan partikel terkecil sebagai bola positif yang bermuatan dengan elektron tersebar di dalamnya seperti kue kismis.
Thomson berpendapat bahwa elektron terdistribusi merata di dalam partikel terkecil yang bermuatan positif. Model ini memberikan pemahaman awal tentang adanya partikel bermuatan negatif di dalam atom.
Dalam mengembangkan teorinya, Thomson mengungkapkan bahwa secara keseluruhan partikel terkecil ini memiliki sifat netral. Ini disebabkan adanya elektron bermuatan negatif yang membutuhkan partikel bermuatan positif lainnya yang berfungsi untuk menetralisir muatan negatif yang ada pada unsur dasar partikel.
Keunggulan dan Kelemahan
Secara umum, keunggulan teori yang dikemukakan oleh Joseph John Thomson membuat kita sampai pada kesimpulan sebagai berikut:
- Atom bukanlah partikel terkecil.
- Atom secara keseluruhan memiliki sifat netral.
- Massa elektron lebih kecil daripada massa partikel terkecil ini.
- Unsur dasar partikel yang bermuatan positif akan tersebar di seluruh atom dan kemudian dinetralisir oleh elektron-elektron.
- Atom yang bermuatan netral memiliki muatan positif dan muatan negatif yang seimbang. Dengan kata lain, tidak ada kelebihan muatan positif atau negatif pada atom.
Bagaimanapun, teori Thomson memiliki kelemahan. Teori ini tidak dikembangkan lebih lanjut dan bertentangan dengan teori partikel terkecil yang dikemukakan oleh Ernest Rutherford. Teori Ernest Rutherford membuktikan bahwa muatan positif pada partikel terkecil ini tidak tersebar merata.
Teori Thomson juga tidak dapat menjelaskan asal muatan positif dan muatan negatif dalam partikel terkecil ini. Selain itu, Joseph John Thomson tidak mengetahui adanya inti di dalam atom itu sendiri.
Meskipun teori Thomson memiliki kelemahan, kontribusinya tetap penting dalam pemahaman awal tentang struktur partikel terkecil ini. Teori ini membuka jalan bagi penelitian lebih lanjut yang mengarah pada perkembangan model yang lebih kompleks dan akurat.
3. Teori Atom Rutherford
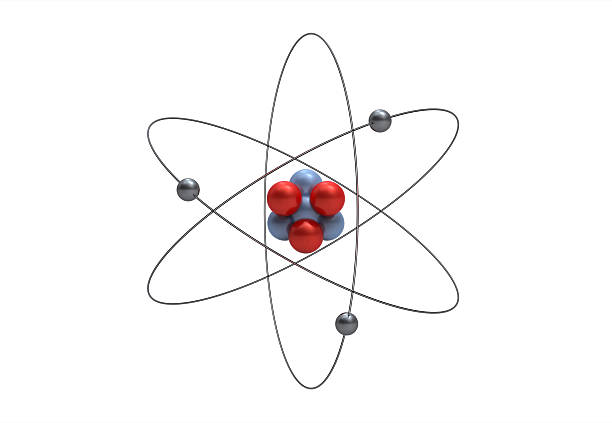
Model atom Rutherford, yang dikembangkan oleh Ernest Rutherford pada tahun 1911, mengubah pandangan kita tentang struktur partikel terkecil ini. Teori ini berdasarkan hasil percobaan Rutherford yang dikenal sebagai eksperimen hamburan partikel alfa.
Dalam eksperimen ini, partikel alfa ditembakkan ke suatu target tipis yang terdiri dari materi, seperti emas. Melalui hasil percobaan tersebut, Rutherford menemukan beberapa hal yang mengubah pemahaman kita tentang atom.
Eksperimen ini menunjukkan bahwa atom terdiri dari inti kecil yang bermuatan positif yang disebut inti atom, di sekitarnya terdapat elektron yang bergerak dalam ruang hampa. Mengapa demikian kesimpulannya?
Dari eksperimen, diketahui bahwa partikel alfa yang ditembakkan mengenai inti partikel terkecil yang membuat terjadinya tumbukan. Dengan begitu, tumbukan tersebut menyebabkan pembelokan atau pemantulan partikel alfa.
Dengan demikian, eksperimen Rutherford menunjukkan bahwa sebagian besar massa terkonsentrasi di dalam inti atom. Berdasarkan percobaan hamburan partikel alfa, teori ini menunjukkan bahwa sebagian besar ruang dalam atom adalah hampa, sedangkan muatan positif terkonsentrasi di inti atom.
Sebagai kesimpulan, begini poin-poin menurut teori ini:
- Atom memiliki inti yang sangat kecil dan padat di pusatnya. Inti ini terdiri dari partikel bermuatan positif yang disebut proton.
- Rutherford menyimpulkan bahwa sebagian besar massa atom dan muatan positifnya terkonsentrasi dalam inti partikel terkecil ini.
- Sementara itu, elektron-elektron yang bermuatan negatif bergerak mengelilingi inti dalam ruang yang luas.
Keunggulan dan Kelemahan
Keunggulan utama Teori Rutherford adalah penemuan inti atom yang padat dan bermuatan positif. Ini menjelaskan mengapa partikel alfa dalam percobaan hamburan Rutherford mengalami tumbukan dengan sudut yang bervariasi.
Beberapa partikel alfa mengalami hamburan terkecil karena melintasi ruang kosong di antara inti partikel terkecil ini, sementara yang lain mengalami hamburan yang lebih besar karena tumbukan langsung dengan inti atom.
Teori Rutherford juga memberikan gambaran baru tentang ukuran partikel terkecil ini. Dengan mengeksplorasi perilaku partikel alfa dalam percobaan hamburan, Rutherford menyimpulkan bahwa ukuran partikel ini relatif kecil dibandingkan dengan ruang di sekitarnya yang dianggap kosong.
Penemuan ini membuka jalan bagi pemahaman kita tentang tingkat kepadatan dan kompaknya struktur atom.
Namun, Teori Rutherford juga memiliki beberapa kelemahan. Salah satunya adalah bahwa teori ini tidak dapat menjelaskan mengapa elektron-elektron tidak jatuh ke inti yang bermuatan positif.
Menurut fisika klasik, partikel bermuatan negatif yang bergerak dalam medan bermuatan positif akan kehilangan energi dan jatuh ke inti. Namun, dalam teori Rutherford, ini tidak terjadi dan mekanisme stabilitas elektron masih perlu dijelaskan.
Selain itu, teori Rutherford juga mengabaikan peran interaksi elektromagnetik dalam struktur partikel terkecil ini. Teori ini lebih fokus pada penemuan inti atom, sementara interaksi elektron dengan inti dan dengan elektron lainnya tidak dijelaskan secara rinci.
4. Teori Atom Bohr
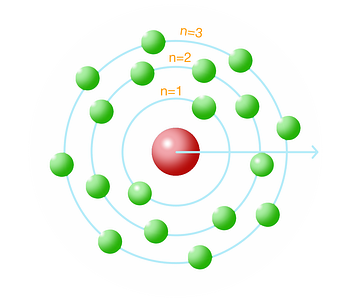
Teori atom Bohr, yang diusulkan oleh Niels Bohr pada tahun 1913, memperkenalkan konsep orbit elektron. Bohr menyatakan bahwa elektron bergerak dalam orbit tertentu dengan energi yang tetap dan tidak menyerap atau memancarkan energi saat berada dalam orbit tersebut.
Teori ini menyajikan model atom dengan orbit terkuantifikasi di sekitar inti partikel terkecil ini yang mengandung proton dan neutron. Dalam teori ini, Bohr mengusulkan bahwa perubahan energi elektron hanya terjadi ketika elektron melompat dari satu orbit ke orbit lain yang memiliki energi berbeda.
Keunggulan dan Kelemahan
Salah satu keunggulan utama teori Bohr adalah kemampuannya menjelaskan spektrum garis dari elemen-elemen. Ketika elektron melompat dari satu orbit ke orbit lain yang lebih rendah, energi yang dilepaskan atau diserap akan berupa foton dengan frekuensi dan panjang gelombang yang spesifik.
Fenomena tersebut menjelaskan mengapa setiap unsur memiliki pola garis spektrum yang unik, yang digunakan dalam analisis spektroskopi untuk mengidentifikasi unsur-unsur.
Teori Bohr juga memperkenalkan konsep energi terkuantifikasi. Menurut teori ini, energi elektron dalam atom hanya dapat memiliki nilai diskrit atau terkuantifikasi, bukan nilai kontinu seperti yang diprediksi oleh fisika klasik.
Artinya, elektron hanya dapat menghuni orbit-orbit dengan energi tertentu dan tidak di antara orbit tersebut. Konsep energi terkuantifikasi ini penting karena memperjelas bahwa perilaku partikel subatomik tidak selalu mengikuti aturan fisika klasik.
Namun, ada juga beberapa kelemahan dalam teori yang disampaikan Bohr. Teori ini tidak dapat menjelaskan dengan akurat sebab pergerakan elektron dalam atom yang lebih kompleks. Model Bohr hanya berlaku untuk partikel terkecil dengan satu elektron, seperti atom hidrogen.
Ketika kita beralih ke partikel terkecil dengan banyak elektron, seperti atom karbon atau oksigen, pergerakan elektron yang kompleks dan interaksi antara elektron-elektron menjadi lebih sulit untuk dijelaskan oleh model ini.
Selain itu, teori Bohr tidak dapat memberikan penjelasan rinci tentang interaksi atom dengan partikel lain, seperti reaksi kimia. Teori ini lebih fokus pada pergerakan elektron dalam atom dan mengabaikan interaksi partikel terkecil ini dengan lingkungan eksternal.
Meskipun memiliki keterbatasan, Teori Bohr memberikan kontribusi penting dalam pemahaman awal tentang struktur partikel terkecil ini dan memperkenalkan konsep energi terkuantifikasi. Teori ini menjadi landasan bagi perkembangan lebih lanjut dalam mekanika kuantum dan pemahaman tentang sifat partikel subatomik.
5. Teori Atom Kuantum

Teori Atom Kuantum merupakan kerangka kerja teoritis yang dikembangkan oleh para fisikawan seperti Schrödinger, Heisenberg, dan Dirac. Ia didasarkan pada prinsip mekanika kuantum, yang merupakan kerangka kerja matematika yang digunakan untuk menjelaskan perilaku partikel-partikel subatomik.
Teori ini menggambarkan elektron sebagai partikel dan gelombang secara bersamaan dan menggunakan konsep bilangan kuantum untuk menjelaskan distribusi elektron dalam orbital atom.
Selain itu, teori ini menyatakan bahwa atom terdiri dari partikel dasar yang disebut partikel subatomik. Partikel subatomik ini mencakup proton, neutron, dan elektron. Menurut teori ini, elektron yang bermuatan negatif mengorbit dalam “kulit” energi yang berbeda di sekitar inti yang terdiri dari proton dan neutron.
Setiap kulit energi ini memiliki level energi kuantum tertentu yang menentukan posisi dan tingkat energi elektron.
Salah satu prinsip utama dalam teori Kuantum adalah prinsip eksklusi Pauli, yang menyatakan bahwa dalam suatu partikel terkecil tidak ada dua elektron yang bisa memiliki keempat bilangan kuantum yang sama. Ini berarti bahwa setiap elektron memiliki keadaan kuantum unik dan terpisah di dalam atom.
Selain itu, teori yang satu ini juga menjelaskan adanya fenomena diskrit dalam spektrum partikel terkecil. Ketika atom menerima atau memancarkan energi, seperti dalam spektroskopi, terjadi perubahan energi pada tingkat diskrit.
Fenomena ini sesuai dengan prinsip kuantum bahwa energi atom terkuantifikasi, yaitu hanya ada nilai energi tertentu yang diizinkan.
Sebagai tambahan, teori Kuantum juga menjelaskan tentang prinsip ketidakpastian Heisenberg, yang menyatakan bahwa kita tidak dapat secara tepat mengetahui posisi dan momentum suatu partikel secara bersamaan. Ini berarti ada batas ketidakpastian dalam mengukur sifat-sifat partikel subatomik.
Keunggulan dan Kelemahan
Keunggulan utama teori Kuantum adalah kemampuannya untuk menjelaskan perilaku atom yang tidak dapat dijelaskan oleh teori sebelumnya, seperti teori Rutherford. Teori Kuantum dapat menjelaskan spektrum partikel terkecil ini dengan presisi yang tinggi, dan dapat memprediksi perilaku dan sifat atom dengan tepat.
Namun, teori Kuantum juga kompleks dan melibatkan perhitungan matematika yang rumit. Konsep-konsep seperti fungsi gelombang, orbital, dan probabilitas seringkali sulit dipahami secara intuitif.
Selain itu, teori Kuantum masih merupakan bidang aktif penelitian dengan pengembangan dan penemuan baru yang terus dilakukan untuk memperdalam pemahaman kita tentang partikel terkecil ini dan dunia kuantum.
Secara keseluruhan, teori Kuantum merupakan tonggak penting dalam pemahaman kita tentang atom dan dunia mikroskopik. Teori ini memberikan kerangka kerja matematis yang kuat untuk memodelkan perilaku atom dan telah memungkinkan kemajuan besar dalam fisika dan kimia modern.
Partikel Penyusun Atom
Atom terdiri dari tiga partikel dasar, yaitu proton, neutron, dan elektron. Partikel penyusun partikel terkecil ini berinteraksi satu sama lain melalui gaya elektromagnetik dan gaya nuklir yang kompleks.
Interaksi ini memengaruhi sifat dan perilaku atom, termasuk muatan listrik, massa, stabilitas, dan kemampuan partikel terkecil untuk membentuk ikatan kimia.
1. Proton
Proton adalah sebuah partikel bermuatan positif yang ada di dalam inti atom. Massa proton relatif lebih besar dibandingkan dengan massa elektron. Namun, proton memiliki massa yang relatif sama dengan neutron, dan keduanya disebut sebagai nukleon.
Muatan positif proton sebanding dengan muatan negatif elektron, sehingga secara keseluruhan partikel terkecil ini menjadi netral. Selain itu, jumlah proton dalam inti partikel terkecil ini menentukan identitas unsur tersebut.
2. Neutron
Neutron adalah sebuah unsur dasar netral yang terdapat di dalam inti atom. Struktur netral ini jumlah massanya hampir sama dengan proton. Kehadiran neutron dalam inti partikel terkecil ini memengaruhi stabilitas dan isotop suatu unsur.
Neutron juga berperan dalam menjaga jarak antar proton dalam inti partikel terkecil agar tetap stabil.
3. Elektron
Elektron adalah partikel bermuatan negatif yang bergerak dalam orbit di sekitar inti partikel terkecil ini. Ia memiliki massa yang sangat kecil daripada proton dan neutron. Jumlah dan konfigurasi elektron dalam sebuah atom menentukan sifat-sifat kimia dari unsur tersebut.
Selain ketiga partikel tersebut, ada juga partikel lain yang terkait dengan fisika partikel, seperti kuark dan lepton. Kuark adalah partikel dasar yang membentuk proton dan neutron, sedangkan lepton termasuk kelompok partikel yang mencakup elektron dan neutrino.
Namun, dalam konteks kimia dan pemahaman atom secara umum, fokus utama adalah pada proton, neutron, dan elektron. Begini rangkuman ketiga partikel tersebut dalam tabel.
| Partikel | Muatan Listrik | Massa Relatif | Lokasi | Peran Utama |
| Proton | Positif (+) | 1 | Inti Atom | Mempengaruhi identitas unsur dan muatan atom |
| Neutron | Netral (0) | 1 | Inti Atom | Mempengaruhi stabilitas dan massa atom |
| Elektron | Negatif (-) | Sangat kecil | Orbitals | Menentukan sifat kimia dan reaktivitas atom |
Struktur Atom
Struktur atom mengacu pada susunan partikel penyusun partikel terkecil ini dan pengorganisasian mereka di dalamnya. Seperti yang sudah dijelaskan di atas, unsur dasar terdiri dari tiga partikel subatomik utama: proton, neutron, dan elektron. Beginilah jenis-jenis model yang sudah pernah diperkenalkan.
1. Model Atom Bola Billiard
Model Bola Billiard adalah salah satu model awal untuk menjelaskan struktur partikel terkecil ini. Model partikel ini dianggap sebagai bola padat yang tidak memiliki struktur internal yang terdefinisi. Ia diusulkan oleh Dalton pada abad ke-19 dan tidak menjelaskan tentang muatan dan massa partikel atomik.
2. Planet Rutherford
Model Planet Rutherford, yang juga dikenal sebagai Model Rutherford-Bohr, menggambarkan atom sebagai sistem tata surya mini. Dalam model ini, inti partikel yang bermuatan positif berfungsi sebagai matahari, sedangkan elektron yang bermuatan negatif bergerak mengelilingi inti dalam orbit yang ditentukan.
Model ini diusulkan oleh Rutherford dan dikembangkan oleh Bohr. Namun, model ini memiliki kelemahan karena tidak dapat menjelaskan mengapa elektron tidak jatuh ke inti dan mengapa ada spektrum garis-emisi yang diskrit.
3. Model Atom Kuantum
Model Kuantum, juga dikenal sebagai Model Mekanika Kuantum, menggambarkan perilaku elektron dalam atom menggunakan prinsip-prinsip mekanika kuantum.
Model ini dikembangkan oleh sejumlah ilmuwan seperti Schrödinger, Heisenberg, dan Dirac. Menurut model ini, elektron tidak bergerak dalam orbit yang ditentukan, tetapi berada dalam orbital yang merupakan wilayah probabilitas di sekitar inti partikel terkecil ini.
Sudah Paham Mengenai Teori Atom?
Pemahaman partikel terkecil tentang teori, partikel penyusun, dan struktur sangat penting dalam studi kimia. Atom terdiri dari proton, neutron, dan elektron yang membentuk inti dan daerah di sekitarnya. Terdapat banyak konsep dan teori yang memberikan gambaran tentang struktur atom.
Dengan memahami struktur ini, kita dapat menjelaskan sifat dan perilaku zat serta menerapkan pengetahuan ini dalam berbagai aplikasi kimia. Selain itu, penting untuk mencatat bahwa teori ini terus berkembang seiring dengan perkembangan ilmu pengetahuan dan teknologi.