Kita sering mendengar istilah sifat koligatif larutan ketika ada di dalam kelas kimia. Sifat koligatif larutan berkaitan dengan perubahan fisik pada larutan. Namun, apa sih pengertian lengkap dan bagaimana rumus-rumus sifat koligatif larutan? Selain itu, apa saja jenisnya?
Maka dari itu, yuk, simak artikel ini supaya paham konsep ini dengan lebih baik! Ada contoh soalnya juga!
Daftar ISI
- Definisi dan Konsep Sifat koligatif Larutan
- Sifat koligatif pada Larutan Elektrolit dan Non-Elektrolit
- Rumus Konsentrasi Larutan dalam Kaitannya dengan Sifat Koligatif Larutan
- Lalu, Apa saja Rumus Sifat Koligatif Larutan?
- Contoh Soal Rumus Sifat koligatif Larutan dan Pembahasannya
- Ingat Terus Rumus Keempat Jenis Sifat koligatif Larutan, Ya!
Definisi dan Konsep Sifat koligatif Larutan
Supaya nanti lebih mudah mempelajari rumus sifat koligatif larutan, mari kita pahami teori dasarnya terlebih dahulu.
Sifat koligatif larutan adalah sifat-sifat yang terkait dengan perubahan fisik larutan, yang tidak tergantung pada jenis partikel terlarut dalam larutan, tetapi hanya pada jumlahnya. Contohnya, seperti penurunan tekanan uap, kenaikan titik didih, penurunan titik beku, dan tekanan osmotik.
Konsep dasar sifat koligatif mengacu pada hukum Raoult. Raoult menyatakan bahwa tekanan uap komponen dalam larutan adalah fungsi dari fraksi mol komponen tersebut dalam larutan. Dengan kata lain, makin banyak partikel terlarut dalam larutan, makin besar efek sifat koligatifnya.
Penjelasan di atas turut menerangkan alasan mengapa jenis partikel tidak ada hubungannya dengan sifat koligatif larutan.
Sifat koligatif pada Larutan Elektrolit dan Non-Elektrolit
Tahukah kamu bahwa sifat-sifat koligatif larutan dapat berbeda antara larutan elektrolit dan non-elektrolit? Mengapa demikian? Pasalnya, larutan elektrolit mengandung partikel yang dapat menghasilkan ion, misalnya, ion-ion dalam larutan garam).
Sedangkan larutan non-elektrolit tidak mengandung partikel yang menghasilkan ion (misalnya, gula).
Lantaran jumlah partikel yang mengion pada larutan elektrolit lebih banyak daripada non-elektrolit, maka efek sifat koligatifnya lebih kuat pada larutan elektrolit. Oleh karena itu, perubahan tekanan uap, titik didih, titik beku, dan tekanan osmotik lebih signifikan dalam larutan elektrolit.
Rumus Konsentrasi Larutan dalam Kaitannya dengan Sifat Koligatif Larutan
Sebelum kita membahas berbagai rumus berbagai jenis sifat koligatif larutan, perlu kamu ingat dan pahami kembali beberapa jenis konsentrasi larutan yang berperan dalam konsep ini. Ada tiga (3) jenis konsentrasi larutan yang penting yang dibahas dalam penjelasan di bawah ini.
1. Molaritas (M)
Pertama, terdapat Molaritas (M), yaitu jumlah mol zat terlarut dalam satu liter larutan. Rumusnya adalah:
M = n (mol) /V (L)
Selain rumus dasarnya, terdapat rumus pengganti, yaitu;
M = (m zat terlarut (g)/ Mr zat terlarut (g/mol)) x (1/ V (L))
Namun, jika yang kamu ketahui adalah massa jenis dan molalitas pelarutnya, maka rumus yang dapat kamu gunakan adalah:
M = (m (mol/g) x ρ (g/mL))/massa molar zat terlarut (g/mol)
Di mana (n) adalah jumlah mol zat terlarut, (V) adalah volume larutan, dan (m) adalah molalitas, sedangkan (ρ) adalah massa jenis.
2. Molalitas (m)
Sedangkan molalitas (m) adalah jumlah mol zat terlarut dalam satu kilogram pelarut. Begini rumus dasarnya:
m = n (mol)/ massa pelarut (kg)
Namun, selain rumus dasar tersebut, ada rumus lain yang harus kamu pahami jika kita mengetahui nilai molaritasnya, maka rumusnya yaitu:
m = (M x ρ (g/mL))/Mr zat terlarut (g/mol)
3. Fraksi Mol
Jenis konsentrasi berikutnya yaitu fraksi mol. Fraksi mol adalah perbandingan jumlah mol zat terlarut dengan jumlah total mol dalam larutan. Bagaimana rumus dasarnya?
Fraksi Mol Zat Terlarut = n Zat Terlarut (mol)/ n Total dalam Larutan (mol)
Selain rumus dasar di atas, kamu juga bisa menyatakan fraksi mol dengan rumus di bawah ini jika yang kamu ketahui adalah nilai molaritas dan molalitasnya.
Fraksi Mol= M / (1000 x m)
Pada rumus di atas, (M) adalah molaritas dan (m) adalah molalitas.
Jika yang kamu ketahui adalah persen massa atau persen volume, maka kamu bisa menggunakan dua rumus di bawah ini:
Fraksi Mol = %m/m / 100
atau
Fraksi Mol = %V/V / 100
Lalu, Apa saja Rumus Sifat Koligatif Larutan?
Sifat-sifat koligatif larutan dapat dikelompokkan menjadi empat klasifikasi utama. Apa saja dan bagaimana rumus untuk masing-masing klasifikasi tersebut? Yuk, simak penjelasannya.
1. Penurunan Tekanan Uap (∆P)
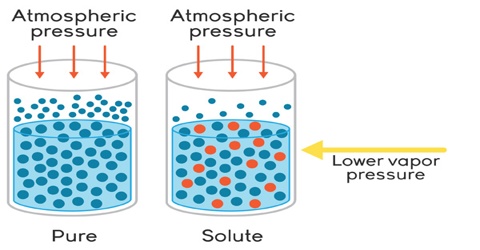
Penurunan tekanan uap adalah fenomena di mana tekanan uap suatu larutan lebih rendah daripada tekanan uap pelarut murni pada suhu yang sama. Rumus sederhananya adalah:
ΔP = P pelarut murni – P larutan
Akan tetapi, jika kamu belum mengetahui nilai tekanan pelarut murni dan larutan, maka kamu harus memakai rumus lainnya. Caranya adalah dengan menghubungkan penurunan tekanan uap larutan (∆P) dengan molalitas, melalui rumus berikut:
ΔP =m x Kv
Dalam rumus ini, (Kv) adalah tetapan volume molekuler.
2. Kenaikan Titik Didih (∆Tb)
Selanjutnya, terdapat rumus sifat koligatif larutan kenaikan titik didih (∆Tb), yaitu peningkatan suhu titik didih larutan dibandingkan dengan titik didih pelarut murni pada tekanan yang sama. Jika kamu sudah mengetahui titik didih (Tb) pelarut murni dan titik didih (Tb) larutan, maka kamu bisa memakai rumus sederhana berikut:
ΔTb = Tb larutan – Tb pelarut murni
Sedangkan rumus di bawah ini bisa kamu pakai jika nilai Tb pelarut murni dan larutan belum diketahui:
ΔTb = i x Kb x Fraksi Mol
atau
ΔTb = (1000/ρ) x Kb
Dalam rumus ini, (i) merupakan faktor van’t Hoff yang menyatakan jumlah partikel setelah ionisasi (untuk larutan elektrolit), (Kb) adalah tetapan ebullioskopik, dan (ρ) adalah persen massa zat terlarut dalam 1000 mL larutan.
3. Penurunan Titik Beku (∆Tf)
Ada pula rumus penurunan titik beku (ΔTf). Sesuai namanya, penurunan titik beku adalah penurunan suhu titik beku larutan dibandingkan dengan titik beku pelarut murni pada tekanan yang sama. Rumusnya adalah:
ΔTf = Tf pelarut murni – Tf larutan.
dengan (Tf) yang mewakili titik beku.
Jika belum mengetahui nilai titik beku dari pelarut murni atau titik beku larutannya, maka kamu juga bisa menggunakan rumus di bawah ini:
ΔTf = Kf x m
Dalam rumus ini, (Kf) adalah tetapan kriometrik dan (m) adalah molalitas larutan.
4. Tekanan Osmotik (π)
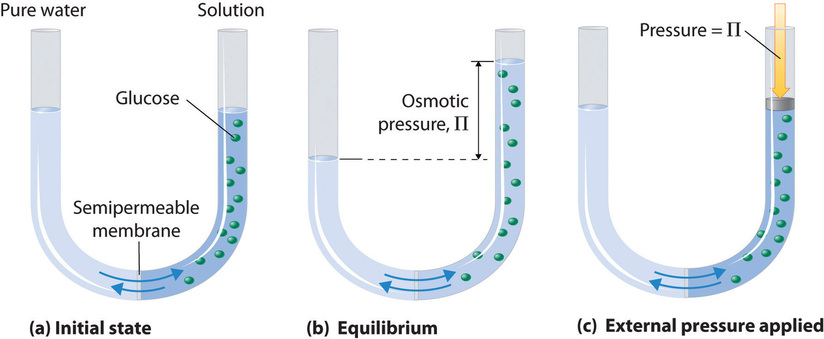
Kemudian, rumus sifat koligatif larutan yang terakhir yaitu tekanan osmotik. Tekanan osmotik (π) adalah tekanan yang diperlukan untuk mencegah aliran pelarut murni ke dalam larutan melalui membran semipermeabel. Rumusnya adalah:
π = i x M x R x T
Dalam rumus ini, (i) adalah faktor van’t Hoff, (M) adalah molaritas larutan, ® adalah konstanta gas, sedangkan (T) adalah suhu dalam satuan kelvin.
Namun, jika dari soal yang diketahui adalah (%m/m) atau persen massa zat terlarutnya, maka gunakanlah rumus berikut:
π = (ρ/100) x R x T
Berdasarkan rumus di atas, (ρ) merupakan persen massa zat terlarut dalam 100 gram larutan. Sementara, (R) adalah konstanta gas, dan (T) mewakili suhu dalam satuan Kelvin.
Contoh Soal Rumus Sifat koligatif Larutan dan Pembahasannya
Mari simak contoh soal yang tersedia di bawah ini untuk dapat memahami aplikasi rumus-rumus yang telah diberikan di atas.
Contoh Soal 1: Penurunan Tekanan Uap (∆P)
Sebuah larutan mengandung 0,2 mol gula (C12H22O11) dalam 500 mL air pada suhu 25°C. Hitung penurunan tekanan uap larutan dibandingkan dengan tekanan uap air murni pada suhu yang sama.
Pembahasan
a. Langkah 1: Hitung molalitas larutan gula.
m = n zat terlarut (mol)/massa pelarut (kg)
m = 0,2 mol/0,5 kg =0,4 mol/kg
b. Langkah 2: Hitung penurunan tekanan uap.
ΔP=m⋅K
K = 0,512 K kg/mol K=0,512K kg/mol (konstanta kenaikan titik didih air pada 25°C)
ΔP = 0,4 mol/kg x 0,512 K kg/mol = 0,205 K Pa
Jadi, penurunan tekanan uap larutan adalah 0,205 K Pa.
Contoh Soal 2: Penurunan Titik Beku (∆Tf)
Sebuah larutan etilen glikol (C2H6O2) mengandung 0,3 mol etilen glikol dalam 100 g air pada suhu 0°C. Hitung penurunan titik beku larutan dibandingkan dengan titik beku air murni pada tekanan yang sama.
Pembahasan:
a. Langkah 1: Hitung molalitas larutan etilen glikol.
m = n zat terlarut/massa pelarut (kg)
m = 0,3 mol/0,1 kg =3 mol/kg
b. Langkah 2: Hitung penurunan titik beku.
ΔTf=Kf x m
Kf = 1,86 K kg/mol (konstanta penurunan titik beku air)
ΔTf= 3 mol/kg x 1,86 K kg/mol = 5,58 K
Jadi, penurunan titik beku larutan adalah 5,58 K.
Ingat Terus Rumus Keempat Jenis Sifat koligatif Larutan, Ya!
Kesimpulannya, sifat-sifat koligatif larutan membuat kita memahami bagaimana larutan dapat memengaruhi perubahan fisik suatu zat. Nah, setelah membaca artikel ini, kita telah mengetahui rumus untuk 4 jenis sifat koligatif larutan.
Melalui contoh soal dan pembahasan di atas, tentunya kamu akan lebih memahami rumus sifat koligatif larutan. Kamu dapat menghubungkan berbagai rumus sifat koligatif larutan dengan rumus konsentrasi larutan sesuai dengan kebutuhan perhitungan.




