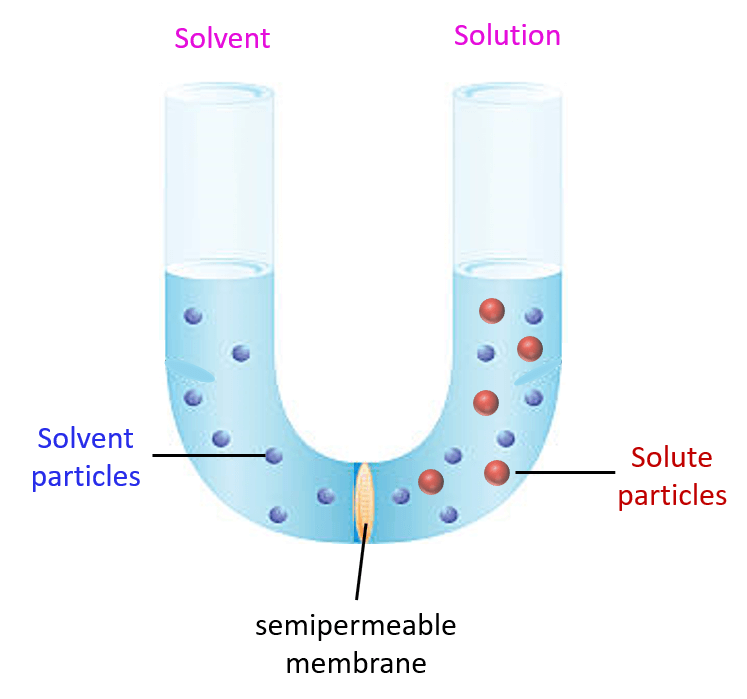
Tahukah Anda bahwa tekanan osmosis adalah fenomena alami yang terjadi ketika suatu zat terlarut (solusi) dengan konsentrasi yang berbeda dipisahkan oleh membran semipermeabel?
Yap, osmosis berperan penting dalam proses pergerakan air dan zat-zat terlarut di dalam sel, serta memiliki berbagai manfaat dalam berbagai bidang. Dalam artikel ini, kita akan mendalami materi ini, mulai dari konsep, sampai rumus, serta contoh soal dan pembahasan terkait tekanan osmosis.
Pengertian dan Konsep Tekanan Osmosis
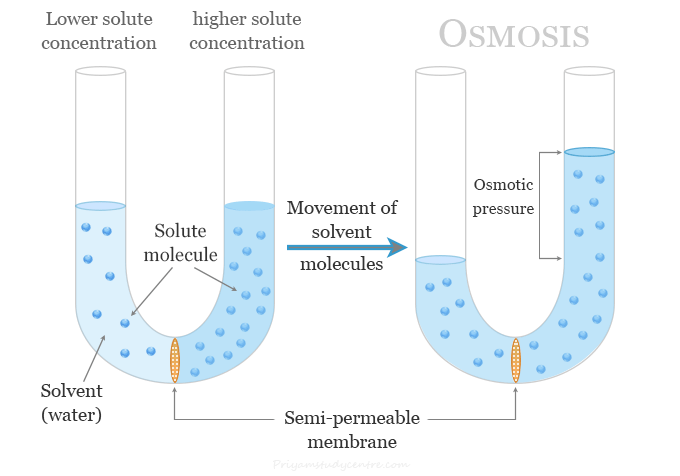
Sederhananya, tekanan osmosis adalah suatu pergerakan air melalui membran semipermeabel dari larutan dengan konsentrasi zat terlarut yang lebih rendah ke larutan dengan konsentrasi zat terlarut yang lebih tinggi.
Fenomena ini terjadi karena molekul air cenderung bergerak dari area dengan konsentrasi air yang lebih tinggi ke area dengan konsentrasi air yang lebih rendah untuk mencapai kesetimbangan.
Biasanya, air yang berkonsentrasi tinggi memiliki konsentrasi zat terlarut yang lebih rendah. Sedangkan air berkonsentrasi rendah memiliki konsentrasi zat terlarut yang lebih tinggi.
Sementara membran semipermeabel adalah jenis membran yang memungkinkan beberapa molekul atau partikel untuk melewati atau menembusnya. Tetapi juga bisa menghalangi molekul atau partikel lainnya.
Sebab, membran ini memiliki pori-pori atau struktur tertentu yang memungkinkan hanya molekul-molekul tertentu dengan ukuran atau muatan tertentu untuk melewatinya. Selain itu, penggunaan membran semipermeabel sering juga dalam proses osmosis, difusi, dan filtrasi dalam berbagai aplikasi ilmiah dan teknologi.
Pergerakan air melalui membran selama osmosis terjadi tanpa memerlukan energi. Jadi, tekanan osmosis terjadi ketika ada perbedaan konsentrasi zat terlarut antara dua larutan yang dipisahkan oleh membran semi-permeabel.
Jika larutan dengan konsentrasi zat terlarut yang lebih tinggi berada di satu sisi membran. Maka air akan bergerak dari larutan dengan konsentrasi zat terlarut yang lebih rendah ke larutan dengan konsentrasi zat terlarut yang lebih tinggi. Tujuannya adalah untuk menyeimbangkan konsentrasi di kedua sisi membran.
Manfaat Tekanan Osmosis
Tekanan osmosis memiliki berbagai manfaat dalam kehidupan sehari-hari dan berbagai bidang ilmu, di antaranya adalah:
1. Proses Absorpsi pada Tumbuhan
Osmosis berperan penting dalam penyerapan air dan zat-zat nutrisi oleh akar tumbuhan melalui membran sel. Proses ini memungkinkan tumbuhan untuk mendapatkan air dan nutrisi yang diperlukan untuk pertumbuhan dan perkembangan mereka.
2. Proses Filtrasi pada Ginjal
Selain itu, osmosis juga berperan dalam proses filtrasi pada ginjal. Zat-zat yang tubuh butuhkan akan disaring dari darah, kemudian air akan diserap kembali ke dalam tubuh melalui osmosis.
3. Proses Kontraksi pada Sel Darah Merah
Osmosis mempengaruhi volume sel darah merah. Ketika sel darah merah berada dalam lingkungan dengan konsentrasi zat terlarut yang lebih tinggi daripada darah, air akan keluar dari sel dan menyebabkan sel darah merah menjadi mengkerut.
4. Teknologi Reverse Osmosis
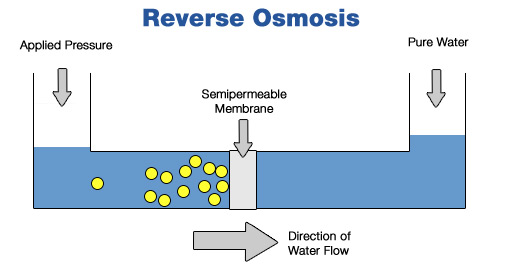
Sementara dalam industri, teknologi reverse osmosis bermanfaat untuk menyaring air dan memisahkan zat-zat terlarut dari air untuk menghasilkan air bersih. Teknologi reverse osmosis telah menjadi solusi yang efektif untuk menghasilkan air berkualitas tinggi dalam berbagai sektor dan meningkatkan efisiensi penggunaan air.
5. Pengawetan Makanan
Terakhir, osmosis juga berperan dalam proses pengawetan makanan, seperti dalam pengawetan makanan dengan garam atau gula. Penggunaan tekanan osmosis dalam pengawetan makanan telah menjadi metode yang berguna untuk memperpanjang umur simpan produk makanan dan menjaga kualitasnya.
Faktor yang Mempengaruhi Tekanan Osmosis
Sementara itu, terdapat beberapa faktor yang dapat mempengaruhi osmosis. Apa sajakah itu? Ketahui jawaban selengkapnya di bawah ini:
1. Perbedaan Konsentrasi
Pertama, osmosis berbanding lurus dengan perbedaan konsentrasi zat terlarut antara dua larutan. Tekanan akan semakin tinggi jika perbedaan tersebut semakin besar.
2. Suhu
Kemudian, pada suhu yang lebih tinggi, pergerakan molekul air lebih cepat. Sehingga tekanan osmosis dapat meningkat.
3. Tipe Membran
Selain itu, karakteristik membran semipermeabel, seperti pori-pori dan ketebalan membran, juga dapat mempengaruhi osmosis.
4. Tekanan Luar
Jika terdapat tekanan eksternal yang dikenakan pada salah satu sisi membran. Maka faktor ini juga dapat mempengaruhi laju dan arah osmosis.
Rumus Terkait Tekanan Osmosis
Terdapat beberapa rumus yang akan Anda gunakan dalam menghitung tekanan, tergantung pada kondisi dan jenis osmosis yang terjadi. Dua rumus utama yang umum digunakan adalah rumus osmosis ideal dan osmosis real.
1. Tekanan Osmosis (Π) pada Osmosis Ideal
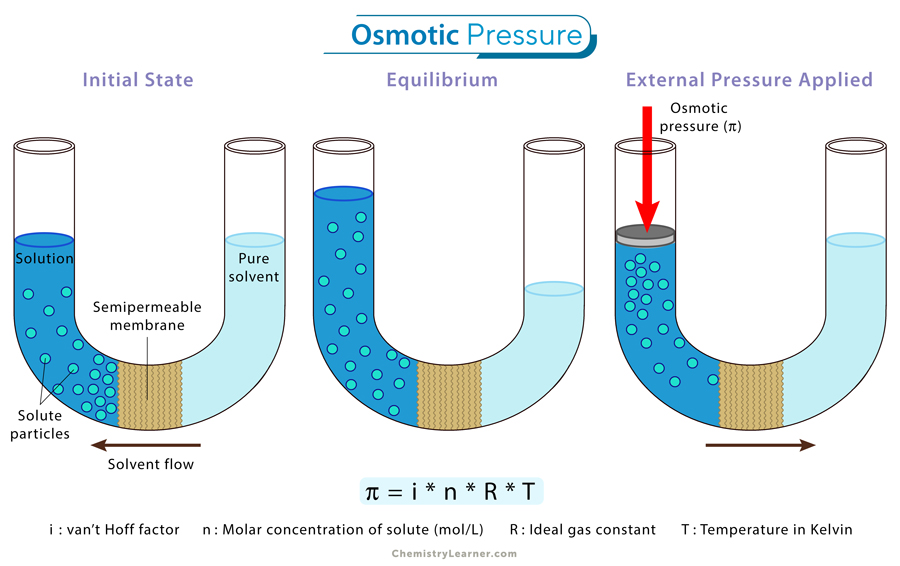
Penggunaan rumus pada osmosis ideal yaitu ketika larutan yang mengalami osmosis adalah larutan yang sangat encer atau “perfectly dilute solution“. Sehingga, tekanan yang dihasilkan dapat dianggap ideal.
Π = i x n x R x T
Keterangan:
- Π = tekanan osmosis (Pa)
- i = koefisien van’t Hoff (jumlah partikel terionisasi dalam larutan)
- n = molalitas larutan (mol solute/kg solvent)
- R = konstanta gas (R = 8,314 J/mol.K)
- T = suhu (K)
Perlu Anda ingat, bahwa solute adalah zat yang terlarut. Sedangkan solvent adalah zat pelarutnya.
2. Tekanan Osmosis (Π) pada Osmosis Real
Kemudian, penggunaan rumus pada osmosis real adalah ketika larutan yang mengalami osmosis tidak dapat dianggap sebagai larutan yang sangat encer. Sehingga, memerlukan faktor koreksi (Φ) untuk memperhitungkan ketidak-idealitasnya.
Π = i x n x R x T x Φ
Keterangan:
- i = koefisien van’t Hoff (jumlah partikel terionisasi dalam larutan)
- n = molalitas larutan (mol solute/kg solvent)
- R = konstanta gas (R = 8,314 J/mol.K)
- T = suhu (K)
- Φ = faktor koreksi van’t Hoff (bernilai antara 0 dan 1.
3. Perbedaan Tekanan Osmosis (ΔΠ)
Adapun cara menghitung perbedaan antara dua larutan adalah:
ΔΠ = Π1 – Π2
Keterangan:
- ΔΠ = perbedaan Π antara dua larutan (Pa)
- Π1 = Π dari larutan pertama (Pa)
- Π2 = Π dari larutan kedua (Pa)
Contoh Soal Terkait Tekanan Osmosis dan Pembahasannya
Simak tiga contoh soal di bawah ini agar Anda memahami materi ini dengan lebih dalam, sebab ada pembahasannya juga!
1. Contoh Soal 1
Sebuah larutan garam memiliki molalitas 0,2 mol/kg air dan suhu sekitar 25°C. Jika koefisien van’t Hoff (i) untuk larutan garam adalah 2,1, dan faktor koreksi (Φ) untuk larutan tersebut adalah 0,9. Maka hitunglah tekanan pada larutan tersebut!
Diketahui:
Molalitas larutan (n) = 0,2 mol/kg air
Suhu (T) = 25°C = 298 K
Koefisien van’t Hoff (i) = 2,1
Konstanta gas (R) = 8,314 J/mol.K
Faktor koreksi (Φ) = 0,9
Pada kasus ini, kita akan menggunakan rumus tekanan pada osmosis real:
Π = i x n x R x T x Φ
Substitusi nilai:
Π = 2,1 x 0,2 mol/kg x 8,314 J/mol.K x 298 K x 0,9
Π = 2,1 x 0,2 x 8,314 x 298 x 0,9 ≈ 112,673 Pa
Jadi, tekanan pada larutan garam tersebut adalah sekitar 112,673 Pa.
2. Contoh Soal 2
Sebuah sel darah merah ditempatkan dalam larutan gula dengan molalitas 0,1 mol/kg air pada suhu 37°C. Jika koefisien van’t Hoff (i) untuk larutan gula adalah 1,8, hitunglah tekanan osmosis yang dialami oleh sel darah merah tersebut.
Diketahui:
Molalitas larutan (n) = 0,1 mol/kg air
Suhu (T) = 37°C = 310 K
Koefisien van’t Hoff (i) = 1,8
Konstanta gas (R) = 8,314 J/mol.K
Sementara pada kasus ini, kita akan menggunakan rumus tekanan pada osmosis ideal, karena asumsi larutan gula sebagai larutan yang sangat encer.
Π = i x n x R x T
Substitusi nilai:
Π = 1,8 x 0,1 mol/kg x 8,314 J/mol.K x 310 K
Π = 1,8 x 0,1 x 8,314 x 310 ≈ 54,346 Pa
Jadi, Π yang dialami oleh sel darah merah tersebut adalah sekitar 54,346 Pa.
3. Contoh Soal 3
Sebuah larutan gula memiliki molalitas sebesar 0,2 mol/kg air. Jika suhu sekitar adalah 25°C dan koefisien van’t Hoff (i) untuk larutan gula adalah 1,8, hitunglah tekanan osmosis pada larutan tersebut.
Diketahui:
Molalitas larutan (n) = 0,2 mol/kg air
Suhu (T) = 25°C = 298 K
Koefisien van’t Hoff (i) = 1,8
Konstanta gas (R) = 8,314 J/mol.K
Lalu, pada contoh ini, kita akan menggunakan rumus Π pada osmosis ideal:
Π = i x n x R x T
Kemudian substitusi nilai
Π = 1,8 x 0,2 mol/kg x 8,314 J/mol.K x 298 K
Π = 1,8 x 0,2 x 8,314 x 298 ≈ 89,352 Pa
Sudah Paham Materi Tekanan Osmosis dan Rumusnya?
Tekanan osmosis adalah fenomena penting yang terjadi ketika larutan dengan konsentrasi zat terlarut yang berbeda dipisahkan oleh membran semipermeabel. Rumus-rumus yang telah kami sajikan di atas dapat berguna untuk menghitung tekanan osmosis pada berbagai kondisi dan jenis osmosis.
Ingatlah bahwa jika suatu larutan dapat kita misalkan larutan yang tercampur atau larut sempurna, maka dalam perhitungannya dapat kita anggap sebagai larutan dengan osmosis ideal. Semoga artikel ini memberikan pemahaman yang lebih mendalam tentang materi ini, rumus, dan aplikasinya.