Dalam ilmu kimia, rahasia terbesar yang perlu dipecahkan adalah bagaimana zat-zat berinteraksi dalam reaksi kimia, bagaimana mereka berubah menjadi produk baru, berapa banyak yang diperlukan, dan berapa banyak yang dihasilkan. Untungnya, saat ini stoikiometri adalah titik tolak dari kebutuhan ilmu tersebut.
Istilah ini mungkin terdengar rumit, tetapi pada dasarnya, stoikiometri adalah kunci untuk memahami perhitungan kimia yang mendasar. Dalam artikel ini, kita akan memahami dasar-dasarnya dan mengungkap relevansinya yang mendalam pada kimia modern.
Apa Itu Stoikiometri?
Stoikiometri adalah ilmu yang memfokuskan pengukuran kuantitas, jumlah, atau rasio massa reaktan dan produk kimia dalam reaksi kimia tertentu. Istilah ini berasal dari bahasa Yunani “stoicheion” yang berarti elemen, dan “metron” yang berarti ukuran.
Konsep ini menunjukkan bagaimana hubungan kuantitatif antara produk reaksi kimia dan reaktan (zat-zat yang saling berinteraksi) serta bagaimana cara mengukur jumlahnya.
Oleh sebab itu, stoikiometri adalah cabang ilmu kimia yang menerapkan hukum kekekalan massa, hukum perbandingan berganda, hukum perbandingan tetap, hukum Gay Lussac, hukum Boyle, dan bahkan Hipotesis Avogadro.
Jeremias Benjaim Richter (1792) mendefinisikan istilah ini sebagai ilmu mengukur kuantitas atau rasio massa unsur kimia di mana Anda mungkin menemukan persamaan kimia dan massa suatu reaktan atau produk.
Selanjutnya akan menentukan jumlah reaktan atau produk lain dalam persamaan reaksi kimia. Selain itu, Anda mungkin akan mendapatkan sejumlah reaktan dan produk dan harus menulis persamaan reaksi kimia seimbang yang sesuai dengan matematika.
Secara umum, semua reaksi yang terjadi tergantung pada satu faktor utama, yaitu berapa banyak zat yang ada. Stoikiometris dapat membantu Anda untuk menentukan berapa banyak zat yang Anda butuhkan atau memang sudah ada.
Jenis-jenis Stoikiometri

Terdapat tiga varian stoikiometri dalam ilmu kimia, yaitu reaksi, komposisi, dan gas. Berikut ini adalah penjelasan mengenai jenis-jenis stoikiometri tersebut:
1. Stoikiometri Reaksi
Stoikiometri reaksi membicarakan tentang hubungan kuantitatif antara senyawa atau zat yang terlibat dalam suatu reaksi kimia. Prinsip ini sering digunakan untuk menyelaraskan persamaan reaksi kimia, sehingga jumlah atom atau molekul pada kedua sisi reaksi menjadi setara.
2. Stoikiometri Komposisi
Stoikiometri komposisi membahas tentang hubungan kuantitatif massa atau jumlah atom antara unsur-unsur dalam suatu senyawa kimia. Dalam konteks praktisnya, prinsip ini berguna untuk menggambarkan berapa banyak nitrogen dan hidrogen yang bergabung untuk membentuk amonia kompleks (NH3).
3. Stoikiometri Gas
Jenis stoikiometri ini berkaitan dengan reaksi kimia yang melibatkan gas, dengan mengasumsikan bahwa gas tersebut berperilaku sesuai dengan kondisi ideal, yaitu pada suhu, tekanan, dan volume tertentu. Persamaan gas ideal yang umum digunakan adalah:
P x V = n x R x T
Keterangan:
- P = tekanan dalam satuan atm
- V = volume gas dalam liter
- n = jumlah mol gas
- R = tetapan gas sebesar 0,082 L atm/mol K
- T = suhu dalam Kelvin sebesar 273 K.
Macam-macam Rumus dalam Ilmu Stoikiometri

Berdasarkan penjelasan di atas, stoikiometris adalah konsep penting dalam menentukan jumlah reaktan yang diperlukan untuk menghasilkan produk tertentu. Zat yang terkandung dalam larutan dapat diukur dengan hitungan persen massa, molaritas, fraksi mol, molalitas. Berikut ini penjelasan rumusnya:
1. Persen Massa (w/w%)
Secara spesifik, persen massa menggunakan persamaan sebagai berikut:
Persen Massa = (Massa zat terlarut / Massa larutan) x 100
2. Molaritas
Molaritas atau konsentrasi molar adalah jumlah mol zat yang terlarut dalam 1 liter larutan, umumnya dilambangkan sebagai (M). Rumus molaritas adalah:
Molaritas (M) = Jumlah mol zat-zat terlarut / Volume larutan dalam liter
3. Fraksi mol
Jika suatu zat X mencair dalam zat Y dan jumlah molnya masing-masing adalah nX dan nY, maka fraksi mol X dan Y adalah:
Fraksi mol X = Jumlah mol X / Jumlah mol larutan = nX / (nX + nY)
Fraksi mol Y = Jumlah mol Y / Jumlah mol larutan = nY / (nX + nY)
4. Molalitas
Molalitas atau konsentrasi molal adalah jumlah mol zat terlarut yang ada dalam 1 kg pelarut. Umumnya, lambang molalitas berupa (m). Rumus molalitas adalah:
Molalitas (m) = Jumlah mol zat-zat terlarut / Massa pelarut dalam satuan kg
Stoikiometri dalam kimia adalah jenis matematika yang memungkinkan Anda menentukan dan menghitung jumlah bahan kimia. Ada banyak satuan kuantitatif yang berguna dalam ilmu ini. Beberapa yang sering orang tahu adalah satuan liter dan gram.
Selain itu, berhubung atom, molekul, dan ion bereaksi satu sama lain sesuai dengan rasio molar, Anda juga akan menghadapi masalah di mana Anda perlu mengidentifikasi reaktan pembatas atau reaktan berlebih.
Setelah Anda mengetahui berapa banyak mol dari setiap reaktan yang Anda miliki, Anda perlu membandingkan rasio ini dengan rasio tertentu untuk menyelesaikan reaksi. Reaktan pembatas digunakan sepenuhnya dalam reaksi sebelum reaktan lainnya, sedangkan reaktan berlebih akan tersisa setelah reaksi berlangsung.
Karena reaktan pembatas mendefinisikan dengan tepat berapa banyak dari setiap reaktan yang benar-benar terpakai dalam reaksi, stoikiometri berguna untuk menentukan hasil teoritis. Nilainya dihitung dengan membandingkan molar antara reaktan pembatas dan produk.
Apa Itu Koefisien Stoikiometri?
Koefisien stoikiometri adalah jumlah molekul yang berpartisipasi dalam reaksi. Jika Anda melihat reaksi seimbang, maka Anda dapat melihat bahwa ada jumlah elemen yang sama di kedua sisi persamaan. Koefisien ini umumnya berupa bilangan atau angka yang ada di depan atom, molekul, atau ion.
Kemudian, nilai koefisien dapat berupa pecahan maupun bilangan bulat. Pada intinya, koefisien membantu Anda dalam menentukan rasio mol antara reaktan dan produk. Untuk memahami lebih lanjut tentang koefisien stoikiometris, mari pelajari contoh berikut:
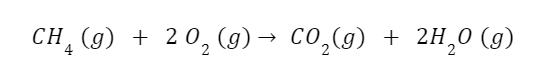
Koefisien 2 untuk H₂O dan O₂ serta 1 untuk CH₄ dan CO₂ adalah angka-angka yang menunjukkan banyaknya molekul dan mol yang terlibat dalam suatu reaksi kimia. Koefisien ini menggambarkan hubungan relatif antara berbagai zat dalam reaksi dan memungkinkan Anda untuk memahami bagaimana reaksi tersebut berlangsung.
Perlu Anda pahami pula bahwa atom dan molekul memiliki ukuran yang sangat kecil, dan jumlahnya dalam suatu zat sangat besar. Oleh karena itu, untuk menggambarkan atau mengukur jumlah atom atau molekul dalam jumlah besar, Anda menggunakan konsep mol.
Satu mol zat apa pun mengandung sekitar 6,022 x 10²³ entitas (atom, molekul, ion, dan lain-lain). Angka ini dikenal sebagai bilangan Avogadro. Massa satu mol zat dalam gram disebut massa molar. Massa molar satu mol suatu zat sama dengan massa rumus atom atau molekulnya secara numerik.
Dengan kata lain, jika Anda memiliki satu mol atom atau molekul suatu zat, maka massa totalnya dalam gram akan sama dengan massa atom atau molekulnya dalam satuan massa atom.
Contoh Soal Tekait Stoikiometri dan Pembahasannya

Untuk membantu Anda memahami konsep ini secara lebih baik, berikut ini adalah beberapa contoh soal tentang stoikiometri beserta pembahasannya secara rinci:
1. Contoh Soal 1
Berapa banyak atom karbon yang ada dalam 0,5 mol asam oksalat (C₂H₂O₄)?
Pembahasan:
1 mol asam oksalat = 6,022 x 10²³ jumlah asam oksalat
0,5 mol asam oksalat = 6,022 x 10²³ x 0,5 jumlah asam oksalat
Karena ada 2 karbon per asam oksalat, maka jumlah atom karbonnya adalah:
Jumlah atom = 0,5 x 6,022 x 10²³ x 2 mol asam oksalat = 6,022 x 10²³
2. Contoh Soal 2
Sampel 0,204 gram logam, M, bereaksi sepenuhnya dengan asam sulfat sebagai berikut:
M + H 2 SO 4 → MSO4 + H 2
Sebuah wadah yang berisi 213 mL gas hidrogen ditempatkan di atas permukaan air. Tinggi air di dalam wadah tersebut sama dengan tinggi air di luar wadah. Tekanan atmosfer pada saat ini adalah 756.0 torr, dan suhu adalah 25.0 °C. Hitung massa molar logam!
Pembahasan:
Gunakan Hukum Tekanan Parsial Dalton untuk menentukan tekanan H2 kering:
756,0 – 23,8 = 732,2 torr
Lalu, ubah nilai tekanan di atas menjadi satuan atm:
732,2 torr / 760,0 torr/atm = 0,9634 atm
Gunakan hukum gas ideal:
P x V = n x R x T
(0,9634 ATM) (0,213 L) = (n) (0,08206 L atm / mol K) (298 K)
n = 0,0083915 mol H2
Dari persamaan seimbang, 1 mol H2 terbentuk ketika 1 mol logam M bereaksi. Oleh karena itu, mol logam yang bereaksi adalah 0,0083915 mol M.
Massa molar M adalah: 0,204 g / 0,0083915 mol = 24,3 g/mol
Sudah Paham Teori Dasar Stoikiometri dalam Reaksi Kimia?
Dalam kesimpulannya, stoikiometri adalah fondasi utama yang membantu Anda memahami reaksi kimia dengan lebih mendalam. Konsep ini membantu mengukur dan memprediksi seberapa banyak zat yang akan terlibat dalam suatu reaksi, seberapa banyak yang akan terbentuk, dan lain sebagainya.
Dengan pemahaman stoikiometri yang baik, Anda dapat merencanakan reaksi kimia dengan lebih efisien. Kemudian, juga dapat menghindari pemborosan bahan kimia dan memastikan bahwa reaksi berjalan sesuai dengan yang keinginan.
Sehingga, pembelajaran stoikiometri bukan hanya sekedar teori, tetapi juga sebagai keterampilan yang sangat berguna dalam aplikasi dunia nyata di laboratorium kimia dan industri. Semoga artikel ini bermanfaat, ya!

