Atom, sebagai unit dasar materi, telah lama menjadi fokus penelitian para ilmuwan untuk mengungkap rahasia yang tersembunyi di dalamnya. Salah satu teori atom yang sangat berpengaruh dan mengubah paradigma pemahaman kita tentang struktur atom adalah Teori Atom Rutherford.
Jadi, dalam artikel ini, kamu akan menjelajahi isi dari Teori Atom Rutherford, termasuk sejarah, percobaan, model atomnya, serta kelebihan dan kekurangannya. Mari kita mulai!
Sejarah Teori Atom Rutherford
Model Atom Rutherford dikemukakan oleh seorang fisikawan bernama Ernest Rutherford pada tahun 1911. Teori ini merupakan hasil dari penelitian dan percobaan yang dilakukan Rutherford bersama dengan rekan-rekannya di Laboratorium Fisika di University of Manchester, Inggris.
Seperti yang kita tahu, pada awal abad ke-19, ilmuwan John Dalton mengemukakan Teori Atom Dalton yang menyatakan bahwa atom adalah partikel terkecil yang tidak dapat dibagi dan memiliki massa serta muatan yang tetap. Namun, teori ini tidak memberikan penjelasan mengenai struktur internal atom.
Pada tahun 1897, Joseph John Thomson mengemukakan Model Atom Plum Pudding yang menyatakan bahwa atom terdiri dari muatan positif yang merata dengan elektron-elektron yang tersebar di dalamnya seperti kue dengan kismis. Model ini menyajikan pandangan baru tentang atom sebagai struktur yang homogen.
Namun, pada awal abad ke-20, Ernest Rutherford dan timnya melakukan percobaan yang mengubah pemahaman kita tentang struktur atom. Rutherford melakukan percobaan menembakkan partikel alpha (inti helium) ke bidang lapisan tipis yang terbuat dari emas.
Percobaan Rutherford
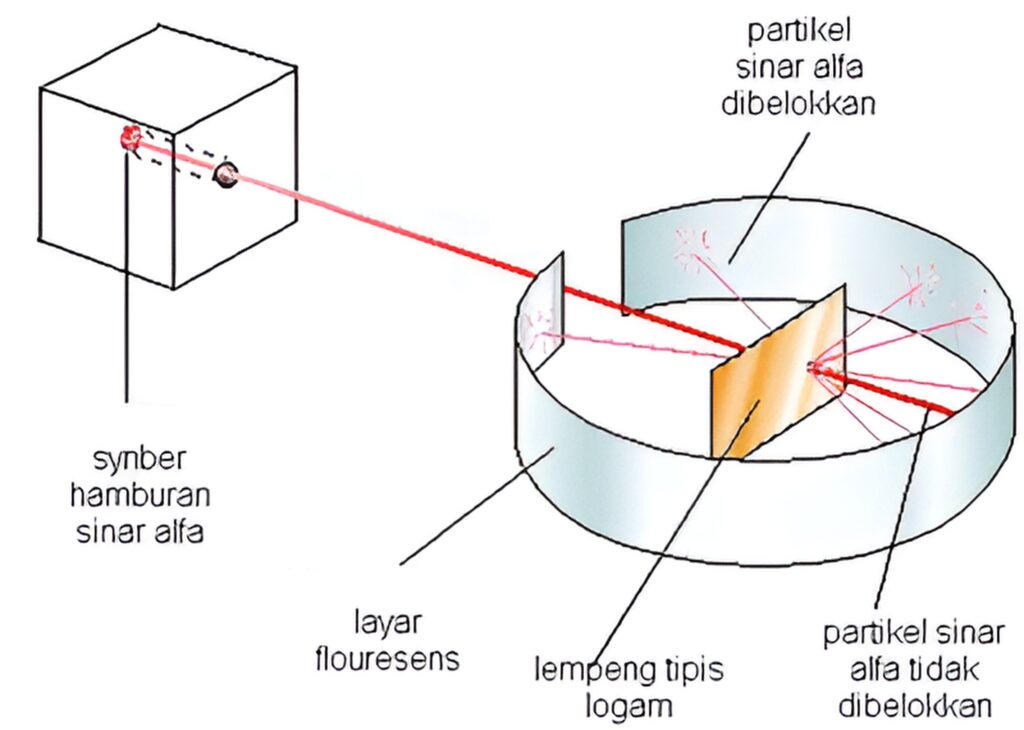
Salah satu percobaan paling terkenal dalam konteks Teori Atom Rutherford adalah percobaan menembakkan partikel alpha ke bidang lapisan tipis yang berwarna keemasan. Dalam percobaan ini, Rutherford dan timnya menggunakan tabung radiasi yang menghasilkan partikel alpha yang bermuatan positif.
Partikel alpha yang bermuatan positif tersebut kemudian ditembakkan ke bidang lapisan tipis yang terbuat dari emas.
Jika merujuk pada teori atom sebelumnya, maka Rutherford mengharapkan bahwa partikel alpha akan merambat melalui lapisan emas, tanpa mengalami banyak penghalang. Karena massa dan muatan partikel yang lebih besar dibandingkan dengan partikel dalam atom.
Namun, ternyata hasil percobaan tersebut mengejutkan. Sebab, sebagian kecil partikel alpha mengalami defleksi (pembelokan) yang signifikan dan bahkan terpantul kembali ke arah sumber partikel.
Dengan demikian, temuan ini bertentangan dengan model atom yang ada saat itu, seperti Model Atom Thomson yang menggambarkan atom sebagai bola positif dengan elektron tersebar di dalamnya.
Kesimpulan Percobaan Rutherford
Hasil pengamatan yang dilakukan oleh Rutherford mengantarkannya pada kesimpulan, bahwa:
1. Sebagian Ruang Atom adalah Kosong
Sebagian besar partikel α yang ditembakkan ke arah lapisan emas melewati lapisan tersebut tanpa mengalami pembelokan, sehingga sebagian besar ruang dalam atom adalah kosong.
2. Muatan Positif Atom Tidak Seperti Kismis
Sementara itu, beberapa partikel α yang mengalami pembelokan oleh lapisan emas, sudut pembelokannya sangat kecil, menunjukkan bahwa muatan positif dalam atom tidak terdistribusi secara merata.
3. Muatan Positif dalam Atom Terkonsentrasi pada Volume Sangat Kecil
Selain itu, dari percobaan tersebut, ternyata hanya sedikit partikel α yang mengalami pembelokan kembali, yaitu hanya beberapa partikel α yang mengalami pembelokan dengan sudut hampir 180 derajat. Oleh karena itu, volume yang diisi oleh partikel bermuatan positif dalam atom sangat kecil dibandingkan dengan volume total atom.
Isi Gagasan Kunci Teori Atom Rutherford
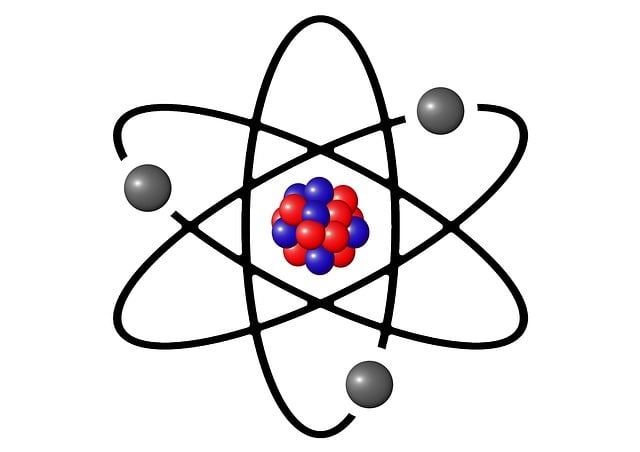
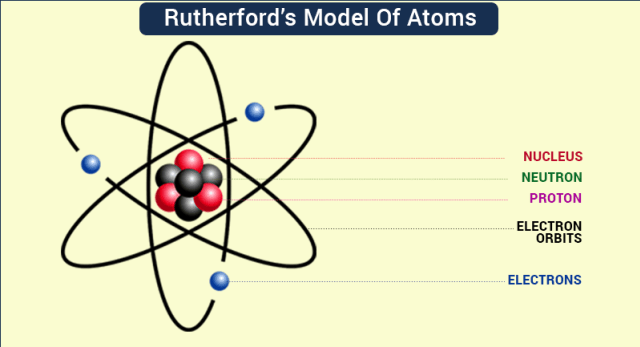
Gagasan utama dalam Teori Atom Rutherford adalah bahwa atom terdiri dari inti yang padat dan bermuatan positif di tengah, yang dikelilingi oleh elektron-elektron yang bergerak dalam orbit melingkar.
Inti atom ini mengandung sebagian besar massa atom, sedangkan elektron-elektron berada di luar inti dengan jarak yang jauh lebih besar dibandingkan dengan ukuran inti. Dengan kata lain, teori ini menyajikan gambaran atom sebagai sistem dengan inti yang padat dan elektron-elektron yang bergerak mengelilinginya.
Maka, gagasan ini bertentangan dengan gagasan yang diusulkan oleh Teori Atom Thomson, yang menggambarkan atom sebagai bola positif dengan elektron tersebar secara merata di dalamnya.
Melalui percobaan menembakkan partikel alpha ke lapisan tipis emas, Rutherford menemukan bahwa sebagian besar partikel alpha melewati atom tanpa bertumbukan yang signifikan. Sementara sebagian kecil mengalami pembelokan dan beberapa bahkan terpantul kembali.
Oleh karena itu, penemuan ini mengindikasikan bahwa sebagian besar atom adalah ruang hampa dengan inti yang sangat kecil, yang menjadi dasar bagi perkembangan Teori Atom Rutherford.
Model Atom Rutherford
Berdasarkan percobaan dan kesimpulan di atas, Rutherford mengusulkan struktur atom unsur. Menurut Teori Atom Rutherford:
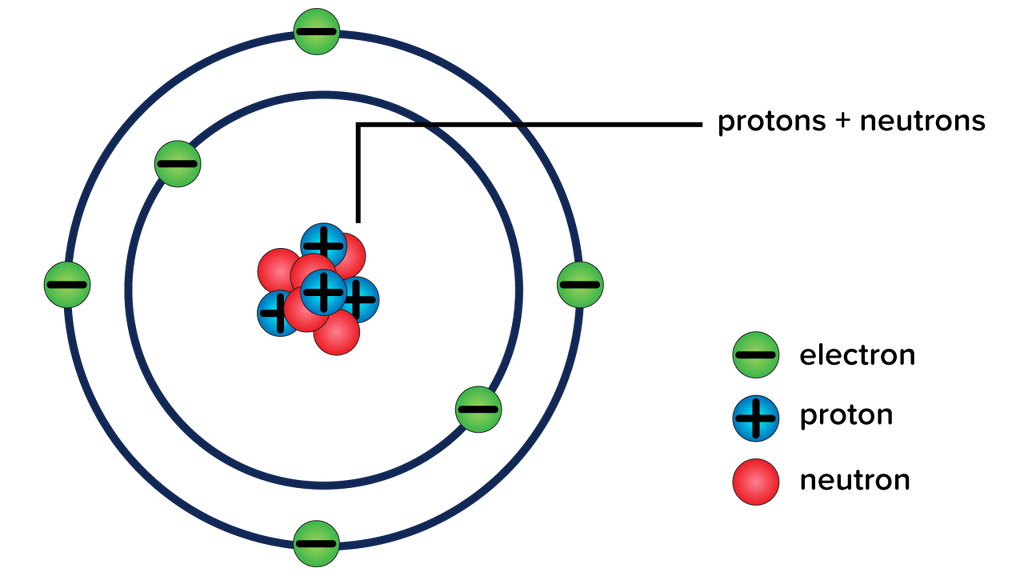
1. Inti Atom
Muatan positif dan sebagian besar massa atom terkonsentrasi dalam volume yang sangat kecil. Rutherford menyebut wilayah atom ini sebagai inti.
2. Elektron Mengelilingi Inti Atom
Selanjutnya, model Rutherford mengusulkan bahwa elektron bermuatan negatif mengelilingi inti atom. Dia juga menyatakan bahwa elektron-elektron yang mengelilingi inti berputar mengelilinginya dengan kecepatan sangat tinggi dalam jalur-jalur melingkar. Lalu, dia menyebut jalur-jalur melingkar ini sebagai orbit.
3. Adanya Gaya Tarik Elektrostatik
Elektron sebagai bermuatan negatif dan inti sebagai massa bermuatan positif yang padat dijaga bersama oleh gaya tarik elektrostatik yang kuat.
Bagaimana Teori Atom Rutherford Menutupi Kekurangan Teori Atom Thompson?
Teori Atom Rutherford berhasil menutupi kekurangan Teori Atom Thomson dengan memberikan pemahaman yang lebih mendalam tentang struktur atom, seperti berikut:
1. Inti Atom yang Padat
Teori Atom Thomson menggambarkan atom sebagai bola positif dengan elektron tersebar di dalamnya secara merata. Namun, Teori Atom Rutherford menunjukkan bahwa atom memiliki inti yang padat dan bermuatan positif di tengahnya.
Rutherford berhasil menjelaskan mengapa sebagian besar partikel alpha yang ditembakkan melewati atom tanpa bertumbukan yang signifikan.
2. Ruang Hampa dalam Atom
Selain itu, teori Rutherford menjelaskan adanya ruang hampa di antara inti atom dan elektron-elektron yang bergerak. Penjelasan ini bertentangan dengan Teori Atom Thomson yang menggambarkan muatan positif dan elektron tersebar merata dalam atom tanpa adanya ruang hampa.
Konsep ruang hampa dalam teori Rutherford menjelaskan mengapa sebagian besar partikel alpha dapat melewati atom tanpa bertumbukan yang signifikan.
3. Konsentrasi Muatan Positif
Terakhir, Teori Atom Thomson tidak memberikan penjelasan tentang distribusi muatan positif dalam atom. Namun, teori Rutherford menunjukkan bahwa muatan positif dalam atom terkonsentrasi dalam inti atom yang sangat kecil.
Jadi, teori ini berhasil menjelaskan mengapa hanya beberapa partikel alpha yang mengalami pembelokan kembali dengan sudut yang besar, karena mereka berinteraksi langsung dengan muatan positif yang terkonsentrasi di inti.
Baca Juga : Menelusuri Teori Atom Dalton Sebagai Bagian Penting Kehidupan Kita
Kelebihan Teori Atom Rutherford
Namun, tak dapat dielakkan bahwa teori ini memiliki beberapa kelebihan yang signifikan dalam kontribusinya mengenai struktur atom, seperti berikut:
1. Penemuan Inti Atom
Teori Atom Rutherford menjadi landasan untuk penemuan bahwa atom memiliki inti yang padat dan bermuatan positif di tengahnya, yang ditemukan melalui percobaan defleksi partikel alpha.
2. Menggambarkan Ruang Hampa dalam Atom
Selain itu, teori ini menjelaskan adanya ruang hampa di antara inti atom dan elektron-elektron. Sehingga, menjelaskan mengapa sebagian besar partikel alpha dapat melewati atom tanpa bertumbukan yang signifikan.
Kelemahan dan Limitasi Teori Atom Rutherford
Meskipun memiliki kelebihan yang signifikan, dan juga didasarkan pada pengamatan eksperimental, namun terdapat kelemahan dan keterbatasan yang perlu diakui, yaitu:
1. Tidak Menjelaskan Stabilitas Atom
Model ini tidak dapat menjelaskan mengapa elektron-elektron tidak jatuh ke inti atom karena adanya gaya tarik elektrostatik antara muatan positif inti dan muatan negatif elektron.
2. Tidak Menjelaskan Spektrum Garis Emisi
Model Rutherford tidak dapat memberikan penjelasan mengenai spektrum garis emisi yang diamati pada atom, di mana atom memancarkan cahaya dalam jumlah energi diskrit.
3. Tidak Menjelaskan Mengapa Elektron Tidak Jatuh ke Inti
Rutherford mengusulkan bahwa elektron berputar mengelilingi inti dalam jalur tetap yang disebut orbit. Namun, menurut teori Maxwell, partikel bermuatan yang berakselerasi akan memancarkan radiasi elektromagnetik, sehingga elektron yang berputar mengelilingi inti seharusnya memancarkan radiasi elektromagnetik.
Radiasi ini akan membawa energi dari gerakan elektron, yang pada akhirnya akan mengakibatkan penyusutan orbit. Pada akhirnya, elektron akan runtuh ke inti. Lalu, perhitungan telah menunjukkan bahwa menurut model Rutherford, elektron akan runtuh ke inti dalam waktu kurang dari 10-8 detik.
Oleh karena itu, model Rutherford tidak sesuai dengan teori Maxwell dan tidak dapat menjelaskan stabilitas atom.
4. Belum Diketahui Susunan Elektron
Salah satu kekurangan model Rutherford adalah bahwa ia tidak memberikan penjelasan mengenai susunan elektron dalam atom, sehingga teorinya menjadi tidak lengkap.
Sudah Paham Mengenai Teori Atom Rutherford?
Melalui percobaan menembakkan partikel alpha ke bidang lapisan tipis emas, Rutherford menyimpulkan bahwa atom sebagian besar terdiri dari ruang hampa dengan inti atom yang kecil dan bermuatan positif di tengahnya.
Model Atom Rutherford menggambarkan atom dengan inti padat di tengah yang dikelilingi oleh elektron-elektron yang bergerak dalam orbit.
Meskipun model ini memiliki kelebihan dalam menjelaskan struktur atom, seperti penemuan inti atom, namun juga memiliki keterbatasan. Dengan pemahaman ini, kita dapat menghargai sumbangan Rutherford dalam perkembangan ilmu pengetahuan atom.