Larutan penyangga adalah jenis larutan kimia yang berperan krusial dalam menjaga stabilitas pH dalam tingkat keasaman atau kebasaan dalam berbagai konteks, mulai dari laboratorium hingga dalam tubuh manusia. Yuk, pelajari info lengkap tentang jenis larutan kimia tersebut dalam pembahasan kali ini!
Apa Itu Larutan Penyangga (Larutan Buffer)?
Dalam bidang ilmu kimia, larutan ini merupakan larutan yang dapat menahan perubahan pH pada penambahan asam atau basa. Baik terdiri dari larutan asam lemah dan basa konjugatnya, atau sebaliknya.
Buffer atau nama lain dari larutan penyangga dan sangat berguna dalam kimia asam basa. Kadang-kadang, ketika larutan bercampur dengan asam atau basa kuat, pH larutannya dapat berubah dengan cepat dan ekstrim.
Keberadaan larutan buffer dapat membantu menetralkan sebagian asam atau basa yang ditambahkan, sehingga pH dapat berubah secara bertahap. Secara lebih mendetail, komponen larutan buffer bereaksi dengan ion hidrogen atau hidroksida sehingga tidak dapat mempengaruhi pH pada kapasitas maksimum.
Namun, larutan tersebut memiliki batasan seberapa banyak dapat menetralkan ketika menahan perubahan pH tersebut. Setelah larutan ini mencapai kapasitasnya, larutan akan bertindak seolah-olah tidak ada larutan buffer atau tidak mempengaruhinya, dan pH dapat berubah secara drastis kembali.
4 Karakteristik Larutan Buffer
Seperti jenis larutan kimia lainnya, jenis larutan ini juga memiliki ciri khasnya, antara lain adalah:
- memiliki nilai pH yang pasti,
- pH-nya tetap sama meskipun untuk waktu yang lama,
- tidak berubah nilai pH-nya pada pengenceran,
- perubahan pH dapat diabaikan dengan penambahan sejumlah kecil asam atau basa.
Apa saja Jenis Larutan Penyangga?
Buffer harus mengandung salah satu dari dua pilihan yaitu: asam lemah dan basa konjugatnya, atau basa lemah dan asam konjugatnya. Cara pemilihan komponen tersebut berkaitan dengan pH larutan yang Anda inginkan.
Pengklasifikasian buffer terbagi menjadi dua jenis, yaitu yang bersifat asam dan buffer bersifat basa.
1. Asam
Buffer asam memiliki pH kurang dari 7 dan terdiri dari asam lemah dan basa konjugatnya sebagai garam. Jika Anda ingin mengubah pH larutan, Anda dapat menyesuaikan rasio asam-garam. Asam yang berbeda (bersama dengan garam konjugatnya) dapat memiliki efek yang bervariasi pada nilai pH.
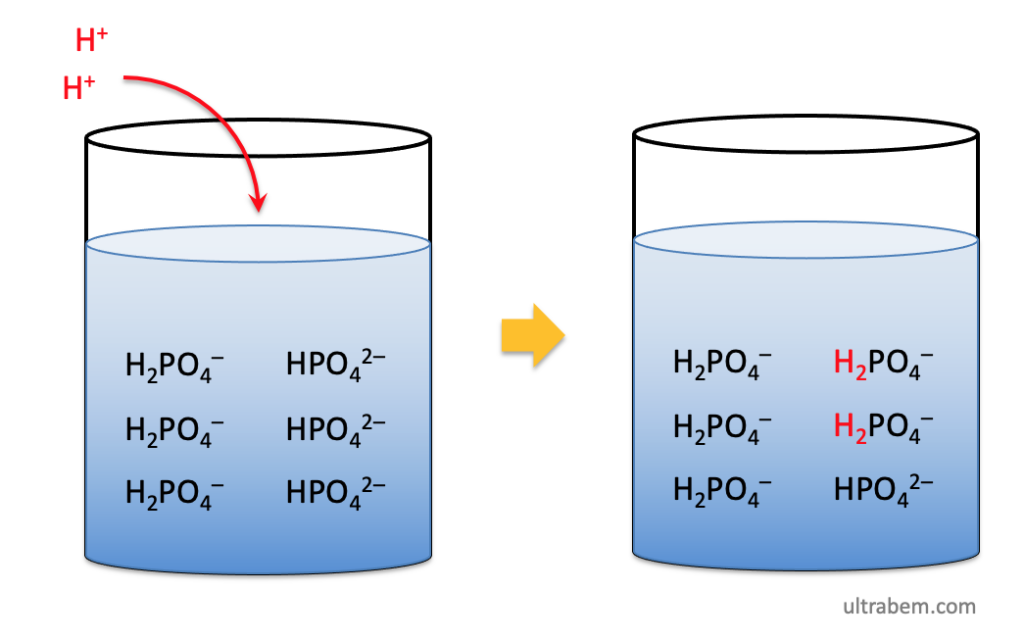
Asam asetat dan natrium asetat adalah contoh asam lemah dan garam konjugatnya dengan nilai pH 4,7. Kesetimbangan asam akan bergerak ke kiri. Namun, jika Anda menambahkan natrium asetat, ion asetat ditambahkan ke dalam larutan. Berdasarkan Prinsip Le Chatelier, keseimbangan kemudian akan beralih ke kiri.
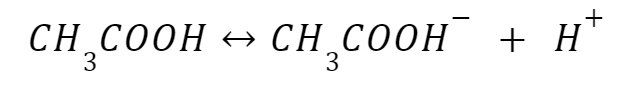
Contoh lain dari larutan penyangga asam adalah asam format (HCHO₂) dan basa konjugatnya (CHO₂⁻)
2. Basa
Nilai pH dari buffer pada jenis ini adalah lebih besar dari 7. Larutan buffer basa terbuat dari basa lemah dan asam konjugatnya sebagai garam. Konsentrasi kedua komponen harus sama untuk memulai. Namun, seperti buffer asam, Anda dapat mengubah pH larutan dengan mengubah rasio antara basa dan garam asam.
Amonia dan amonium klorida adalah contoh basa lemah dengan asam konjugatnya dengan nilai pH 9,25. Keseimbangannya bergerak ke kiri. Namun, jika Anda menambahkan amonium klorida, ion amonium ditambahkan ke dalam larutan. Kali ini, Prinsip Le Chatelier akan menyebabkan keseimbangan bergerak ke kiri.
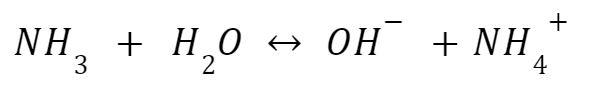
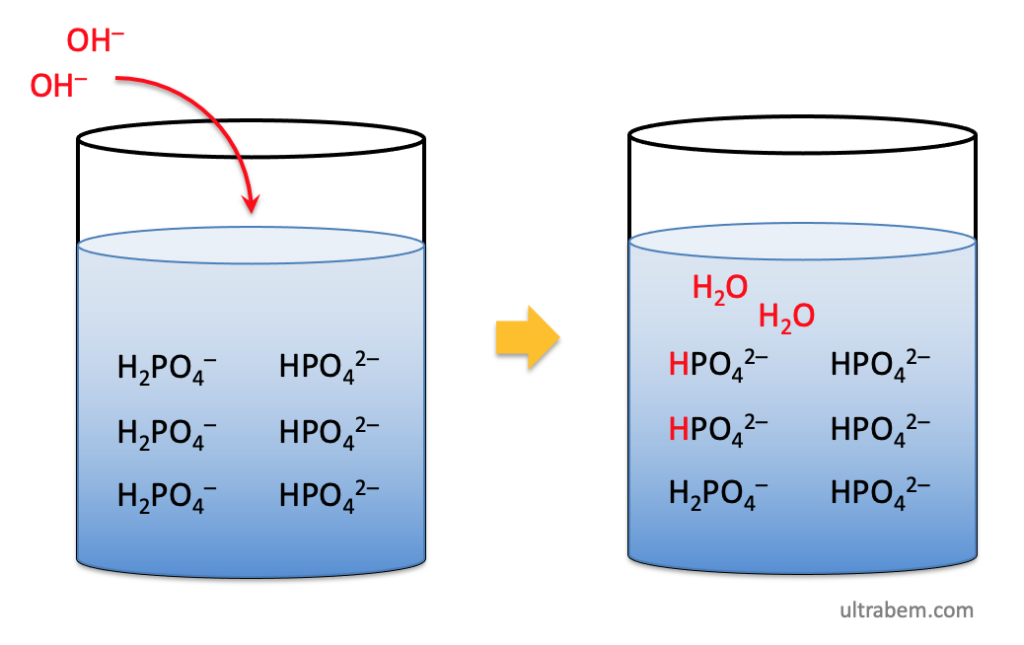
Beberapa contoh lain larutan penyangga basa adalah piridin (C₅H₅N) dan asam konjugatnya (C₅H₅⁺), serta metilamina (CH₃NH₂) dan asam konjugatnya (CH₃NH₃⁺)
Persamaan Henderson Hasselbalch
Ketika Anda membuat larutan buffer menggunakan asam lemah dan basa konjugatnya, maka larutan mempertahankan pH buffer dan dapat menahan perubahan pH tersebut dengan sedikit penambahan asam atau basa.
1. Rumus Buffer Asam
Asam lemah (HA) dan garamnya (KA) dalam larutan penyangga asam dengan basa kuat (KOH). Reaksi yang terjadi adalah asam lemah HA terionisasi, dan kesetimbangannya adalah sebagai berikut:

Persamaan Henderson Hasselbalch adalah persamaan yang menunjukkan hubungan antara pH asam dan pKa-nya untuk menghitung berapa pH buffer. Berikut ini rumus akhirnya:
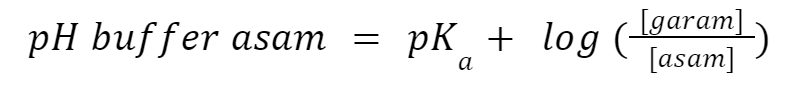
2. Rumus Buffer Basa
Rumus ini mempertimbangkan larutan buffer basa dengan asam kuat, dan basa lemah (B) serta garamnya (BA). Nilai pOH dapat Anda hitung dengan cara yang sama seperti sebelumnya, sehingga rumus yang Anda dapatkan adalah:
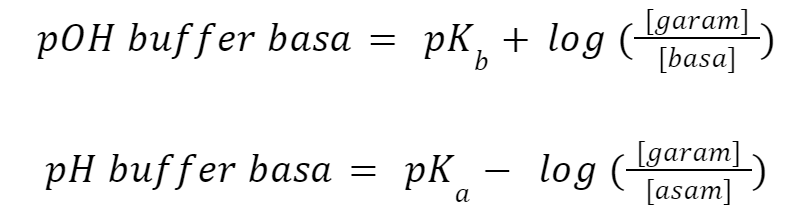
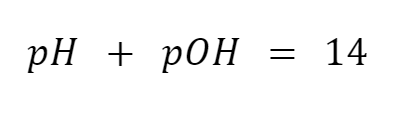
Contoh Soal dan Pembahasan
1. Contoh Soal 1
Berapa pH larutan penyangga dari campuran 1,5 M NH₃ dan 2,5 M NH4Cl dengan penambahan 0,5 M HCl ke larutan?
Pembahasan
Berdasarkan data, pKb amonia adalah 4,75. Dengan demikian,
pKa = 14 – pKb
= 14 – 4,75
= 9,25
Sekarang, dengan menambahkan 0,5 M HCl,
0,5 M ion H tersedia dalam larutan bereaksi dengan 0,5 M NH3 untuk membentuk 0,5 M NH4Cl. Hasilnya, konsentrasi setelah perhitungan amonia menjadi 1 M dan NH4Cl adalah 3 M.
Menggunakan persamaan Henderson Hasselbalch, penyelesaiannya adalah
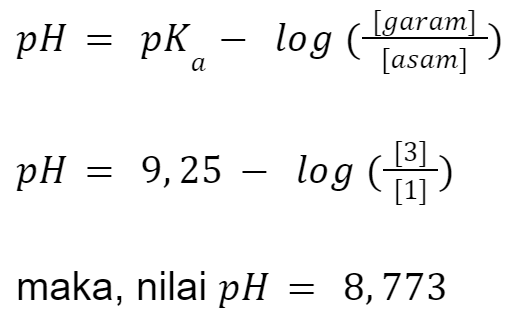
2. Contoh Soal 2
Berapa mol natrium format dan asam format yang diperlukan untuk menyiapkan 1 L larutan buffer 0,25 mol/L dengan pH 4? (pKa Natrium format adalah 3,86)
Pembahasan
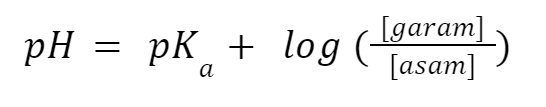

[garam]=1,38 [asam]
Berdasarkan soal bahwa

Dengan demikian, 0,105 mol natrium format dan 0,145 mol asam format yang Anda perlukan untuk membentuk larutan buffer yang diperlukan.
Penggunaan Larutan Penyangga
Seperti telah disinggung di awal, larutan buffer memiliki peran penting dalam berbagai aspek kehidupan. Berikut ini adalah penjelasanya secara singkat.
1. Laboratorium Kimia
Berguna secara luas dalam laboratorium kimia untuk menjaga kondisi dan mengkalibrasi pH tetap stabil selama percobaan dan analisis kimia.
2. Industri Farmasi
Dalam pembuatan obat-obatan, larutan ini bermanfaat untuk mempertahankan pH yang sesuai selama proses produksi.
3. Bidang Kedokteran
Dalam analisis darah, larutan buffer penting untuk mempertahankan pH darah dalam rentang normal melalui bikarbonat, fosfat, dan sistem protein kompleks. pH normal plasma darah adalah 7,4.
4. Pertanian
Di bidang pertanian, kegunaan larutan buffer adalah untuk mengatur pH tanah agar sesuai untuk pertumbuhan tanaman tertentu.
5. Pengolahan Air
Dalam pengolahan air minum, larutan kimia ini berfungsi untuk mengatur pH air agar aman untuk dikonsumsi.
6. Industri Makanan
Kebermanfaatannya di industri makanan adalah menjaga pH makanan dalam kaleng agar tidak gampang rusak dan lebih awet.
7. Industri Tekstil dan Kulit
Anda dapat menggunakan larutan buffer untuk mempertahankan pH yang sesuai untuk pewarna dan mempertahankan tekstur dari kulit.
8. Produk Kebersihan dan Kosmetik
Asam sitrat dan natrium sitrat berguna dalam shampo untuk menetralkan sifat alkali deterjen pada kandungan shampo yang dapat membahayakan kulit kepala.
Sudah Memahami Pentingnya Larutan Penyangga?
Salah satu fungsi utama larutan penyangga adalah kemampuannya untuk menjaga pH tetap stabil. Kelebihan tersebut tidak hanya membuatnya bermanfaat sebagai pengawet, tetapi juga menetralkan zat berbahaya dalam berbagai jenis produk.
Kondisi tersebut menjadikannya komponen yang sangat berharga dalam percobaan laboratorium, industri, dan aplikasi medis.

