Saat belajar ilmu kimia, mungkin Anda akan sering mendengar istilah larutan elektrolit sebagai zat-zat yang dapat menghantarkan arus listrik saat mereka larut dalam air. Namun, tidak semua elektrolit tercipta sama karena ada jenis elektrolit kuat dan elektrolit lemah. Lalu, apa saja contoh larutan elektrolit kuat?
Selain itu, apa saja karakteristik elektrolit kuat dan bagaimana membedakannya dengan elektrolit lemah? Jika Anda memiliki pertanyaan-pertanyaan seperti itu, maka baca artikel ini karena kami akan membahas secara lengkap definisi elektrolit kuat hingga memberikan 20 contoh larutan elektrolit kuat.
Apa Itu Larutan Elektrolit Kuat?
Larutan elektrolit kuat adalah larutan yang terdiri dari suatu jenis zat atau senyawa yang ketika larut dalam air, maka zat atau senyawa tersebut akan terionisasi secara sempurna. Artinya, zat tersebut larut sepenuhnya menjadi ion-ion di dalam air.
Molekul-molekul dalam larutan elektrolit kuat akan terurai secara menyeluruh menjadi kation dan anion. Kation adalah ion dengan muatan positif, sementara anion adalah ion dengan muatan negatif.
Elektrolit kuat sangatlah penting karena mereka memiliki kemampuan untuk menghantarkan arus listrik di dalam larutan. Ketika senyawa elektrolit kuat larut dalam air, ion-ion yang mereka hasilkan mampu bergerak dengan bebas dalam larutan karena mereka memiliki muatan listrik.
Proses itulah yang memungkinkan aliran arus listrik bergerak melalui larutan tersebut. Contoh larutan elektrolit kuat adalah ketika asam klorida (HCl) larut dalam air, maka setiap molekul HCl akan berdisosiasi sepenuhnya menjadi ion hidrogen (H+) dan ion klorida (Cl-).
Pada contoh tersebut, ion hidrogen adalah kation, sedangkan ion klorida berbentuk anion. Kemudian, ketika larutan elektrolit kuat HCl tersebut mengalirkan arus listrik, ion-ion H+ dan Cl- akan bergerak dan membawa muatan listrik. Maka dari itu, larutan HCl adalah konduktor listrik yang baik.
Karakteristik untuk Menentukan Larutan Elektrolit Kuat
Sebelum membahas contoh larutan elektrolit kuat, Anda perlu mengetahui cara mengidentifikasi apakah sebuah larutan termasuk dalam kategori elektrolit kuat atau tidak. Ini dapat dilakukan dengan memperhatikan beberapa ciri khas yang relevan. Apa saja ciri-ciri tersebut?
1. Ionisasi Total
Salah satu ciri khas elektrolit kuat adalah zat atau senyawanya akan berionisasi secara total ketika larut dalam air. Artinya, semua molekul dari senyawa elektrolit kuat di dalam larutan akan terionisasi menjadi ion-ion.
Maka, tidak akan ada molekul senyawa yang masih utuh. Karakteristik inilah yang berbeda dengan elektrolit lemah, di mana hanya sebagian kecil dari molekulnya yang terionisasi.
2. Kemampuan Konduktivitas Listrik yang Baik
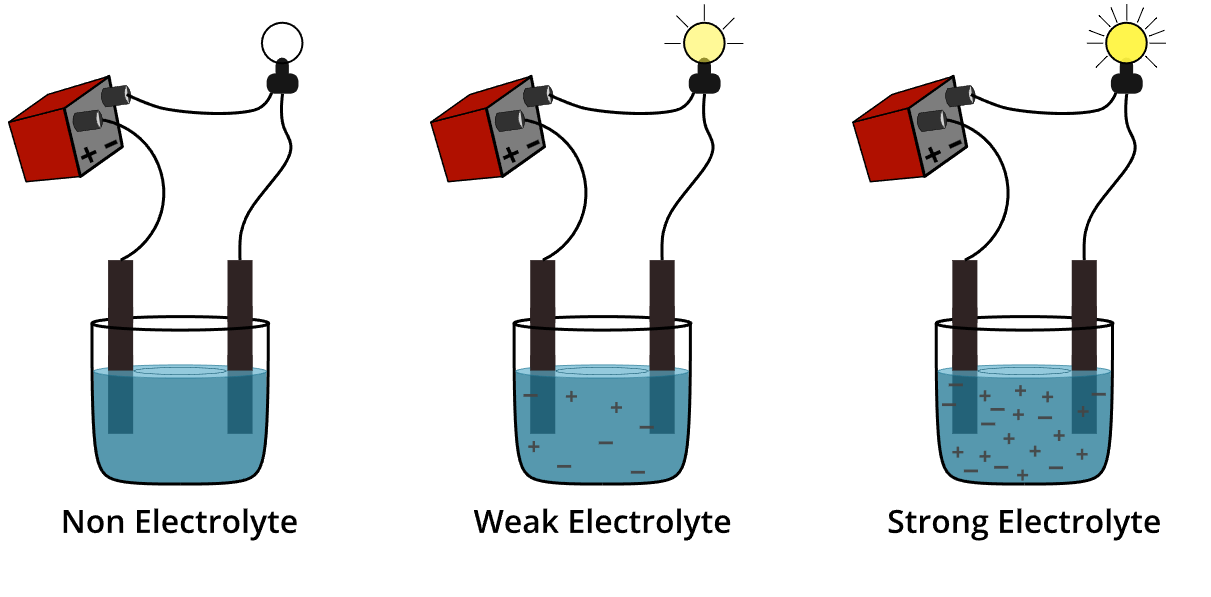
Selain itu, elektrolit kuat memiliki kemampuan yang sangat baik untuk menghantarkan arus listrik dalam larutan. Sebab, ion-ion yang elektrolit hasilkan dapat bergerak dengan mudah dalam larutan. Oleh karena itu, larutan elektrolit kuat akan memiliki konduktivitas listrik yang tinggi.
3. Kekuatan Elektrolit
Fungsi dari kekuatan elektrolit adalah mengukur sejauh mana senyawa tersebut terionisasi dalam larutan. Setiap contoh bentuk elektrolit kuat memiliki tingkat kekuatan elektrolit yang tinggi, bahkan mendekati 100%, karena hampir semua molekulnya terionisasi.
Perbedaan Elektrolit Kuat dan Elektrolit Lemah
Untuk merangkum dan memperjelas pemahaman Anda, berikut adalah tabel perbandingan antara elektrolit kuat dan elektrolit lemah:
| Kriteria | Elektrolit Kuat | Elektrolit Lemah |
| Ionisasi | Mengalami ionisasi total, semua molekulnya terurai menjadi ion-ion dalam larutan. | Mengalami ionisasi sebagian, hanya sebagian molekulnya yang terurai menjadi ion-ion dalam larutan. |
| Kemampuan Menghantarkan Arus | Memiliki kemampuan yang sangat baik untuk menghantarkan arus listrik dalam larutan. | Memiliki kemampuan yang terbatas untuk menghantarkan arus listrik dalam larutan. |
| Kekuatan Elektrolit | Memiliki tingkat kekuatan elektrolit yang tinggi, mendekati 100%. | Memiliki tingkat kekuatan elektrolit yang rendah, kurang dari 100%. |
| Contoh | Asam kuat (HCl), basa kuat (NaOH), garam (NaCl). | Asam lemah (asam asetat), basa lemah (NH4OH), beberapa garam (NH4Cl). |
Persamaan Reaksi Umum untuk Elektrolit Kuat
Reaksi kimia umum yang mewakili elektrolit kuat dapat diilustrasikan dengan persamaan berikut:
AB → A+ + B–
Persamaan di atas mencerminkan fakta bahwa zat AB sebagai zat elektrolit akan membentuk larutan elektrolit kuat saat larut dalam air. Kemudian, AB akan terionisasi sepenuhnya menjadi ion positif (A+) dan ion negatif (B-).
Contoh konkret dari persamaan larutan elektrolit kuat ini adalah reaksi ionisasi asam klorida (HCl) yang telah disebutkan sebelumnya:
HCl → H+ + Cl−
Dalam reaksi HCl tersebut, setiap molekul HCl menghasilkan satu ion H+ dan satu ion Cl–, sehingga terjadi ionisasi total. Ini berarti bahwa dalam larutan asam klorida, tidak ada molekul HCl yang tetap utuh. Semuanya telah berubah menjadi ion-ion yang dapat bergerak secara bebas dalam larutan.
20 Contoh Larutan Elektrolit Kuat dan Penjelasannya

Selanjutnya, pada bagian ini kita akan membahas 20 contoh larutan elektrolit kuat. Pada dasarnya, larutan elektrolit kuat dapat Anda hasilkan dari zat-zat yang termasuk ke dalam tiga kategori, yaitu asam kuat, basa kuat, dan garam yang terbentuk dari asam dan basa kuat.
1. Contoh Larutan Elektrolit Kuat dari Asam Kuat
Pertama, mari kita simak contoh-contohnya yang terbentuk dari asam kuat di bawah ini:
1. Asam Klorida (HCl)
Asam klorida adalah salah satu asam kuat yang paling umum digunakan dalam laboratorium dan industri. Saat HCl larut dalam air, setiap molekul HCl akan terionisasi sepenuhnya menjadi ion hidrogen (H+) dan ion klorida (Cl-).
Jika dituliskan reaksinya, maka bentuknya adalah HCl → H+ + Cl−. Reaksi tersebut menggambarkan reaksi ionisasi total yang merupakan ciri khas elektrolit kuat.
2. Asam Sulfat (H2SO4)
Sementara asam sulfat adalah asam kuat yang sangat korosif. Ketika H2SO4 larut dalam air, mereka akan memisahkan diri menjadi dua ion H+ dan satu ion sulfat (SO42-).
Penulisan reaksi kimianya adalah H2SO4 → 2H+ + SO42-. Dengan demikian, H2SO4 sendiri adalah contoh lain dari larutan elektrolit kuat yang mengalami ionisasi total.
3. Asam Nitrat (HNO3)
Selain itu, terdapat asam nitrat sebagai asam kuat yang sering digunakan dalam sintesis kimia dan industri pupuk. Ketika HNO3 larut dalam air, senyawa-senyawa yang ada di dalamnya akan menghasilkan ion-ion H+ dan ion nitrat (NO3–).
Jika dituliskan reaksinya, maka bentuknya adalah HNO3 → H+ + NO3–. Sebagai larutan elektrolit kuat, HNO3 juga mengalami ionisasi total.
4. Asam Perklorat (HClO4)
Kemudian, asam perklorat adalah asam kuat yang mengandung ion-ion H+ dan ion-ion perklorat (ClO4–). Ketika HClO4 larut dalam air, ion-ion ini akan dilepaskan sepenuhnya sehingga memenuhi persamaan reaksi berikut:
HClO4 → H+ + NO3–
2. Contoh Larutan Elektrolit Kuat dari Basa Kuat

Sedangkan dari kategori basa kuat, berikut adalah contoh-contoh elektrolit kuatnya:
1. Natrium Hidroksida (NaOH)
Natrium hidroksida adalah basa kuat yang berguna untuk berbagai kebutuhan, termasuk produk pembersih dan produksi sabun. Ketika NaOH larut dalam air, senyawa di dalamnya akan menghasilkan ion-ion natrium (Na+) dan ion hidroksida (OH–). Jika dituliskan, maka reaksi kimianya adalah NaOH → Na+ + OH–.
2. Kalium Hidroksida (KOH)
Seperti natrium hidroksida, kalium hidroksida juga memiliki sifat sebagai basa kuat. Saat KOH larut dalam air, mereka juga akan menghasilkan ion-ion kalium (K+) dan ion hidroksida (OH–) dengan derajat ionisasi mendekati 1.
Adapun persamaan reaksi kimianya adalah KOH → K+ + OH–. Karena KOH adalah basa kuat, maka larutan elektrolit yang ia hasilkan juga kuat.
3. Contoh Larutan Elektrolit Kuat dari Garam Kuat
Sementara garam yang bisa membentuk elektronik kuat adalah garam yang dihasilkan dari asam dan basa kuat. Berikut adalah contoh-contohnya:
1. Kalsium Klorida (CaCl2)

Contoh larutan dari garam yang pertama adalah larutan kalsium klorida. Garam kalsium klorida mengandung ion-ion kalsium (Ca2+) dan ion klorida (Cl–). Ketika CaCl2 larut dalam air, kedua ion ini akan dilepaskan dengan sempurna membentuk persamaan kimia berikut:
CaCl2 → Ca2+ + 2Cl–
2. Natrium Klorida (NaCl)
Sementara natrium klorida adalah garam meja yang paling umum digunakan di seluruh dunia. Anda pasti memilikinnya di dapur masing-masing untuk ditaburkan di makanan sebagai pemberi rasa asin.
NaCl adalah salah satu contoh paling sederhana dari larutan elektrolit kuat. Saat NaCl larut dalam air, ia akan terionisasi menjadi ion-ion natrium (Na+) dan ion klorida (Cl–).
Jika kita menulirkan persamaan kimianya, maka akan menjadi NaCl → Na+ + Cl–. Selain digunakan untuk memasak, NaCl juga berguna dalam pemurnian logam dan dalam aplikasi medis.
3. Kalium Bromida (KBr)
Kemudian terdapat kalium bromida. KBr adalah garam yang mengandung ion-ion kalium (K+) dan ion bromida (Br–). Ketika KBr larut dalam air, ion-ion ini akan dilepaskan sepenuhnya ke dalam larutan sesuai persamaan berikut ini:
KBr → K+ + Br–
4. Natrium Fluorida (NaF)
Selanjutnya, natrium fluorida adalah garam yang mengandung ion-ion natrium (Na+) dan ion fluorida (F^-). Saat NaF larut dalam air, kedua ion ini akan berada dalam bentuk yang berionisasi. Persamaan kimianya adalah sebagai berikut:
NaF → Na+ + Br–
5. Kalium Iodida (KI)
Contoh larutan elektrolit kuat selanjutnya yaitu larutan kalium iodida. KI adalah garam yang mengandung ion-ion kalium (K+) dan ion-ion iodida (I^-). Saat KI larut dalam air, ion-ion ini akan dilepaskan sepenuhnya ke dalam larutan mengikuti persamaan kimia:
KI → K+ + I–
6. Ammonium Klorida (NH4Cl)

Ammonium klorida adalah garam yang mengandung ion-ion ammonium (NH4+) dan ion-ion klorida (Cl–). Ketika NH4Cl larut dalam air, ion-ion ini akan dilepaskan sepenuhnya, sehingga derajat ionisasinya 1 yang mana memenuhi kriteria elektrolit kuat. Berikut adalah persamaan kimianya:
NH4Cl → NH4+ + Cl–
7. Kalium Sulfat (K2SO4)
Selain itu, ada juga kalium sulfat sebagai garam yang mengandung ion-ion kalium (K+) dan ion-ion sulfat (SO42-). Ketika K2SO4 larut dalam air, ion-ion ini akan dilepaskan sepenuhnya melepaskan K+ dan SO42-, sehingga persamaan kimianya adalah:
K2SO4 → 2K+ + SO42-
8. Natrium Sulfat (Na2SO4)
Contoh larutan elektrolit kuat dari garam berikutnya yaitu natrium sulfat yang mengandung ion-ion natrium (Na+) dan ion-ion sulfat (SO42-). Saat Na2SO4 larut dalam air, ion-ion ini akan terionisasi sepenuhnya, sehingga memenuhi persamaan:
Na2SO4 → 2Na+ + SO42-
9. Kalium Karbonat (K2CO3)
Kemudian, kalium karbonat adalah garam yang mengandung ion-ion kalium (K+) dan ion-ion karbonat (CO32-). Karena merupakan elektrolit kuat, maka ketika K2CO3 larut dalam air, ion-ion ini akan lepas sepenuhnya dan memenuhi persamaan:
K2CO3 → 2K+ + CO32-
10. Natrium Bikarbonat (NaHCO3)
Lalu, natrium bikarbonat adalah garam yang mengandung ion-ion natrium (Na+) dan ion-ion bikarbonat (HCO3–). Sama seperti yang lainnya, ion-ion tersebut akan lepas sepenuhnya ketika NaHCO3 larut dalam air. Jadi, persamaan kimianya yaitu:
NaHCO3 → Na+ + HCO3–
11. Kalium Perklorat (KClO4)
Kalium perklorat adalah garam yang mengandung ion-ion kalium (K+) dan ion-ion perklorat (ClO4–) Karena penyusun asam basanya adalah jenis yang kuat, maka garamnya juga kuat. Oleh karena itu, ion-ion tersebut akan terionisasi sepenuhnya ketika KClO4 larut dalam air, mengikuti persamaan kimia:
KClO4 → K+ + ClO4–
12. Natrium Nitrat (NaNO3)
Terakhir, contoh larutan elektrolit kuat dari garam adalah natrium nitrat, yaitu garam yang mengandung ion-ion natrium (Na+) dan ion-ion nitrat (NO3-). Maka dari itu, ketika NaNO3 larut dalam air, ion-ion ini akan lepas sepenuhnya dengan persamaan kimia berikut:
NaNO3 → Na+ + NO3–
Sudah Hafal Semua Contoh Larutan Elektrolit Kuat?
Itulah penjelasan lengkap yang perlu Anda ketahui tentang larutan elektrolit kuat beserta 20 contoh larutannya. Perlu Anda ingat bahwa elektrolit kuat mampu untuk sepenuhnya terionisasi di dalam larutan sehingga membuatnya menjadi konduktor listrik yang sangat baik.
Oleh karena itu, perannya sangat banyak dalam berbagai proses kimia dan industri. Kemampuan mereka untuk menghantarkan arus listrik dan berpartisipasi dalam reaksi kimia dengan efisien membuat mereka penting dalam berbagai aplikasi, seperti dalam industri farmasi, kimia, dan metalurgi.

