Energi ionisasi adalah salah satu konsep penting dalam kimia yang berkaitan dengan proses penghapusan elektron dari sebuah atom atau ion. Pemahaman yang baik tentang materi ini memungkinkan kita untuk memahami sifat-sifat reaktif dan perilaku kimia suatu unsur.
Artikel ini akan memberikan penjelasan komprehensif mengenai energi ionisasi, termasuk cara menentukannya dan bagaimana grafik energi ionisasi dapat digunakan untuk menganalisis besarnya dari tiap unsur. Simak selengkapnya!
Daftar ISI
- Pengertian Energi Ionisasi
- Faktor-Faktor yang Memengaruhi Energi Ionisasi
- Tingkatan Energi Ionisasi
- Hubungan Energi Ionisasi dengan Model Atom Bohr
- Rumus Energi Ionisasi
- Cara Menentukan Energi Ionisasi Terbesar dan Terendah
- Grafik Energi Ionisasi dan Artinya dalam Tabel Periodik
- 1. Terdapat Tren Peningkatan dari Kiri ke Kanan
- 2. Tren Peningkatan dari Bawah ke Atas pada Satu Golongan
- 3. Adanya Titik-Titik Penurunan yang Signifikan
- 4. Terdapat Perbedaan Energi Ionisasi pada Tiap Tingkat
- 5. Golongan VIIIA Memiliki Energi Ionisasi Tertinggi
- 6. Pengecualian pada Transisi dalam Periode dan Golongan:
- Contoh Soal
- Sudah Paham Penjelasan Lengkap Energi Ionisasi?
Pengertian Energi Ionisasi
Energi ionisasi atau disingkat EI didefinisikan sebagai energi yang diperlukan untuk mengionisasi atau menghapus satu elektron dari sebuah atom netral dalam keadaan gas. Proses ini terjadi ketika atom menerima energi dari luar dalam bentuk panas, radiasi elektromagnetik, atau tumbukan dengan partikel lain.
Ketika atom menerima energi yang cukup, salah satu elektronnya dapat dikeluarkan, dan menghasilkan ion positif. Proses ini berhubungan dengan kekuatan tarik-menarik antara inti atom dan elektron valensi.
Energi yang diperlukan untuk mengionisasi atom berbeda-beda untuk setiap unsur dan tergantung pada sejumlah faktor.
Faktor-Faktor yang Memengaruhi Energi Ionisasi
Pembahasan selanjutnya adalah mengenai faktor-faktor yang berpengaruh dalam fenomena energi ionisasi. Faktor-faktor tersebut antara lain:
1. Konfigurasi Elektron
Konfigurasi elektron yang stabil, seperti subkulit yang terisi penuh atau separuh terisi, menghasilkan energi yang tinggi karena penghilangan elektron akan mengganggu kestabilannya.
Unsur dengan konfigurasi elektron yang terisi penuh atau separuh terisi, seperti gas mulia, memiliki EI yang sangat tinggi karena konfigurasi elektron mereka yang stabil.
2. Jumlah Elektron
Semakin besar jumlah elektron dalam sebuah atom, semakin kuat gaya tarik antara inti atom dan elektron-elektron tersebut. Oleh karena itu, energi ini cenderung meningkat dengan jumlah elektron yang lebih besar.
3. Jari-jari Atom
Jari-jari atom menentukan jarak antara inti atom dan elektron terluar. Semakin kecil jari-jari atom, semakin dekat elektron-elektron dengan inti atom. Oleh karena itu, atom dengan jari-jari kecil memiliki EI yang lebih tinggi karena gaya tarik antara inti dan elektron-elektron lebih kuat.
Dengan kata lain, terdapat hubungan terbalik antara energi ionisasi dengan jari-jari atom. Hal ini disebabkan elektron-elektron berada lebih jauh dari inti atom, mengalami daya tarik yang lebih lemah, sehingga lebih mudah untuk mengeluarkannya.
Sebaliknya, saat berpindah ke sepanjang suatu periode (baris horizontal), jari-jari atom mengecil, menyebabkan daya tarik inti yang lebih kuat dan EI yang lebih tinggi.
4. Muatan Inti
Muatan inti atau jumlah proton dalam inti atom memengaruhi energi ini. Semakin banyak proton, semakin kuat tarikan inti terhadap elektron, dan EI cenderung meningkat.
5. Kekuatan Interaksi Elektron-Elektron
Elektron-elektron saling mengalami tolakan elektrostatik satu sama lain. Interaksi ini dapat membuat elektron terluar menjadi lebih mudah diionisasi karena adanya tolakan dari elektron-elektron dalam.
6. Kestabilan Elektron
Jika mengionisasi atom mengakibatkan kehilangan elektron dari kulit yang sudah sepenuhnya terisi penuh (seperti kulit valensi), maka EI cenderung lebih tinggi karena harus melawan kestabilan elektron dalam kulit tersebut.
7. Perisai Elektron
Perisai elektron mengacu pada tumpang tindih elektron pada tingkat energi yang berbeda. Semakin banyak kulit elektron yang terdapat antara inti atom dan elektron terluar, semakin besar efek perisai elektron.
Akibatnya, energi ionisasi menurun karena elektron terluar terlindungi dari tarikan inti atom secara penuh. Efek ini berkontribusi pada tren penurunan energi ini ke bawah dalam suatu golongan dalam tabel periodik.
8. Muatan Nuklir Efektif
Muatan nuklir efektif adalah muatan positif bersih yang dialami oleh elektron terluar. Hal ini dipengaruhi oleh jumlah proton dalam inti atom dan efek perisai elektron.
Ketika muatan nuklir efektif meningkat, EI cenderung meningkat juga karena elektron lebih kuat tertarik ke inti atom. Hal ini terlihat saat berpindah dari kiri ke kanan pada suatu periode.
9. Penetrasi Orbital
Beberapa orbital memiliki kemampuan penetrasi yang lebih baik ke dalam lapisan elektron dalam. Elektron-elektron dalam orbital berpenetrasi lebih dekat dengan inti atom, sehingga EI lebih tinggi.
Tingkatan Energi Ionisasi
Tingkatan-tingkatan EI merujuk pada urutan elektron yang dilepas. Baca rincian di bawah untuk mengetahui selengkapnya.
1. EI Pertama
Energi ionisasi pertama (EI-1) merujuk pada energi yang diperlukan untuk melepaskan satu elektron dari sebuah atom netral dalam keadaan dasarnya. Proses ini terjadi ketika atom menerima energi dalam bentuk radiasi atau dalam reaksi kimia tertentu.
EI-1 umumnya diukur dalam satuan elektron volt (eV) atau kilojoule per mol (kJ/mol). Semakin besar EI-1, semakin sulit melepaskan elektron dari atom tersebut.
2. EI Kedua
Energi ionisasi kedua (EI-2) merujuk pada energi yang diperlukan untuk melepaskan elektron kedua dari atom yang telah kehilangan satu elektron sebelumnya.
EI-2 biasanya lebih besar daripada EI-1 karena setelah kehilangan satu elektron, atom tersebut menjadi lebih stabil. Oleh karena itu, melepaskan elektron kedua membutuhkan energi yang lebih besar.
3. EI Ketiga, Keempat, dan Seterusnya
Energi ionisasi ketiga, keempat, dan seterusnya mengacu pada energi yang diperlukan untuk melepaskan elektron ketiga, keempat, dan seterusnya dari sebuah atom yang telah kehilangan elektron sebelumnya.
Setiap energi ionisasi tambahan umumnya meningkat karena semakin dekatnya elektron dengan inti atom dan semakin kuatnya gaya tarik-menarik antara elektron dan inti. Dengan kata lain, semakin sulit melepaskan elektron dengan setiap penambahan jumlah elektron yang telah diionisasi sebelumnya.
Ilustrasi
M + ∆H pertama → M+ + e– ; ∆H pertama = EI-1,
M+ + ∆H kedua →M2+ + e– ; ∆H kedua = EI-2,
dan seterusnya
Hubungan Energi Ionisasi dengan Model Atom Bohr
Hubungan antara EI dengan Model Atom Bohr dapat dijelaskan melalui prinsip dasar yang diperkenalkan oleh model ini.
1. Perbedaan Tingkat Energi dalam Elektron
Model Atom Bohr menyatakan bahwa elektron-elektron dalam atom berada dalam orbit terdefinisi dan memiliki energi tertentu. EI merupakan energi minimum yang diperlukan untuk mengionisasi atau menghapus satu elektron dari kulit terluar atom.
Menurut Model Atom Bohr, elektron-elektron berada dalam orbit dengan tingkat energi tertentu yang terkait dengan jumlah kuantum energi mereka.
Ketika energi yang diberikan pada atom melebihi energi ionisasinya, elektron dapat melompat dari tingkat energi yang lebih rendah ke tingkat energi yang lebih tinggi atau bahkan terlepas dari atom itu sendiri.
Dalam Model Atom Bohr, EI terkait dengan perbedaan energi antara kulit elektron yang terlibat. Semakin besar perbedaan energi antara kulit elektron, semakin tinggi EI. Dengan demikian, semakin jauh kulit elektron yang terlibat dalam ionisasi, semakin tinggi EI yang diperlukan.
2. Konsep Energi dalam Kulit Elektron
Model Atom Bohr juga menjelaskan tentang konsep kulit elektron. Setiap kulit elektron memiliki energi tertentu dan kapasitas maksimum untuk menampung elektron. Ketika EI diperlukan, elektron yang terletak pada kulit terluar akan melompat ke tingkat energi yang lebih tinggi atau terlepas sepenuhnya dari atom.
Dengan demikian, Model Atom Bohr memberikan pemahaman tentang bagaimana EI terkait dengan tingkat energi elektron dalam atom. Perbedaan energi antara kulit elektron dan transisi elektron dari satu tingkat ke tingkat energi yang lain memainkan peranan penting dalam energi ini.
Rumus Energi Ionisasi
Energi ionisasi dapat dihitung dengan menggunakan persamaan matematis yang melibatkan konstanta dan nilai-nilai yang diperoleh dari percobaan.
Rumus umumnya adalah:
Energi ionisasi = Energi akhir – Energi awal
dimana energi akhir adalah energi total atom setelah kehilangan satu elektron dan energi awal adalah energi total atom dalam keadaan netral sebelum kehilangan elektron.
Berikut adalah beberapa rumus yang dapat digunakan dalam menghitung energi ionisasi:
1. Energi Ionisasi
Energi ini adalah energi yang dibutuhkan untuk mengionisasi satu molekul atau atom dari suatu unsur. Tidak ada rumus umum untuk menghitung energi ini secara langsung, tetapi energi ionisasi dapat diukur secara eksperimental.
2. Energi Ionisasi Rata-rata
Energi ionisasi rata-rata suatu unsur dapat dihitung dengan menggunakan rumus berikut:
Energi Ionisasi Rata-rata = (Energi Pertama + Energi Kedua + … + Energi Ke-n) / n
Dalam rumus di atas, n adalah jumlah energi yang dihitung, misalnya jika hanya menghitung dua energi pertama, maka n = 2.
3. Energi Ionisasi Relatif
Energi ionisasi relatif digunakan untuk membandingkan antara dua unsur yang berbeda. Rumusnya adalah:
Energi Ionisasi Relatif = Energi Ionisasi Unsur A / Energi Ionisasi Unsur B
Dalam rumus di atas, EI Unsur A dan Unsur B mewakili EI masing-masing unsur yang dibandingkan.
Perlu diingat bahwa EI tidak selalu dapat dihitung dengan rumus matematis, karena energi ionisasi tergantung pada berbagai faktor seperti struktur elektronik, muatan nuklir, dan interaksi elektron dalam atom. Oleh karena itu, pengukuran eksperimental lebih umum digunakan untuk menentukan energi tersebut.
Cara Menentukan Energi Ionisasi Terbesar dan Terendah
Untuk menentukan energi ionisasi terbesar dan terendah, berikut adalah beberapa langkah yang dapat diikuti:
1. Mengamati Tren dalam Tabel Periodik
Pertama-tama, perhatikan pola tren dalam tabel periodik. Energi ini cenderung meningkat saat berpindah dari kiri ke kanan pada suatu periode dan menurun saat berpindah ke bawah dalam suatu golongan. Artinya, unsur di sebelah kanan dan atas tabel periodik cenderung memiliki EI yang lebih tinggi.
2. Memperhatikan Kelompok Unsur yang Sama
Dalam suatu golongan (kolom vertikal), perhatikan unsur-unsur yang memiliki jumlah kulit elektron yang sama.
EI cenderung meningkat saat berpindah dari atas ke bawah dalam golongan. Misalnya, dalam golongan alkali logam, energi ionisasi meningkat saat berpindah dari atas (misalnya Li) ke bawah (misalnya Cs).
3. Memperhatikan Muatan Nuklir Efektif
Muatan nuklir efektif adalah muatan positif bersih yang dirasakan oleh elektron terluar. Perhatikan unsur-unsur yang memiliki muatan nuklir efektif yang lebih tinggi. Muatan nuklir efektif dipengaruhi oleh jumlah proton dalam inti atom dan efek perisai elektron. Semakin besar muatan nuklir efektif, semakin tinggi energi ionisasinya.
4. Menyimpulkan Berdasarkan Konfigurasi Elektron
Perhatikan konfigurasi elektron unsur. Unsur dengan konfigurasi elektron yang stabil, seperti subkulit yang terisi penuh atau separuh terisi, cenderung memiliki energi ionisasi yang tinggi. Fakta tersebut muncul sebab penghilangan elektron akan mengganggu kestabilan konfigurasi tersebut.
5. Mengacu pada Data dan Tabel Energi Ionisasi
Gunakan sumber daya seperti tabel periodik yang menyediakan data EI unsur. Tabel ini akan memberikan informasi lebih spesifik tentang energi ionisasi masing-masing unsur, memungkinkan Anda untuk membandingkan dan menentukan mana yang memiliki energi yang terbesar dan terendah.
Penting untuk diingat bahwa penentuan energi ini dapat melibatkan beberapa faktor dan bukan hanya satu variabel tunggal. Selain itu, ada pengecualian dan variasi terkait dengan faktor-faktor lain, seperti struktur elektronik, tolakan elektron-elektron, dan ikatan kimia.
Namun, dengan memperhatikan tren umum dalam tabel periodik dan memahami konsep muatan nuklir efektif dan konfigurasi elektron, Anda dapat menentukan energi terbesar dan terendah secara relatif.
Grafik Energi Ionisasi dan Artinya dalam Tabel Periodik
Grafik energi ionisasi menunjukkan hubungan antara EI dengan nomor atom atau massa atom pada sumbu x.
Grafik ini membantu kita memvisualisasikan perubahan energi yang diperlukan untuk mengionisasi atom pada berbagai nomor atom atau massa atom. Pola peningkatan atau penurunan dalam grafik ini memberikan informasi tentang kestabilan ion dan sifat reaktif unsur.
Simak grafik ionisasi yang diberikan di bawah ini.
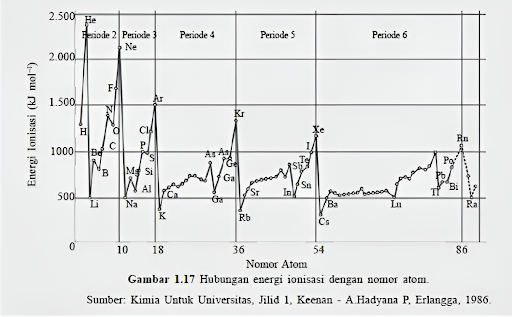
Dari grafik di atas terdapat pola energi ionisasi (EI) dalam sistem periodik. Polanya dapat dijelaskan sebagai berikut:
1. Terdapat Tren Peningkatan dari Kiri ke Kanan
Secara umum, terdapat tren peningkatan EI saat kita bergerak dari kiri ke kanan dalam tabel periodik seiring dengan peningkatan nomor atom. Hal ini terjadi karena peningkatan jumlah proton dalam inti atom, yang menghasilkan gaya tarik yang lebih kuat terhadap elektron valensi.
Hal ini terjadi karena pada periode tersebut, jumlah kulit elektron valensi tetap, sementara muatan inti atom bertambah positif. Akibatnya, volume inti atom menjadi lebih kecil dan jari-jari atom berkurang.
Hal ini mengakibatkan gaya tarik-menarik antara inti atom dan elektron valensi semakin kuat, sehingga EI meningkat.
2. Tren Peningkatan dari Bawah ke Atas pada Satu Golongan
Selain itu, EI juga cenderung meningkat saat kita bergerak dari bawah ke atas dalam suatu golongan seiring peningkatan nomor atom.
Hal ini terjadi karena muatan inti bertambah positif, sementara jumlah kulit elektron bertambah (volume bertambah) dan jari-jari atom meningkat. Akibatnya, gaya tarik-menarik antara inti atom dan elektron valensi menjadi lebih lemah, sehingga EI menurun.
3. Adanya Titik-Titik Penurunan yang Signifikan
Grafik energi ionisasi juga dapat menunjukkan titik-titik penurunan yang signifikan dalam energi ionisasi. Titik-titik ini terkait dengan penghapusan elektron dari konfigurasi elektron stabil, seperti transisi dari subkulit yang terisi penuh ke subkulit yang terisi sebagian atau kosong.
4. Terdapat Perbedaan Energi Ionisasi pada Tiap Tingkat
Energi ionisasi pertama (EI-1) selalu lebih rendah daripada energi ionisasi kedua (EI-2) dan seterusnya. Ini menunjukkan bahwa semakin sulit melepaskan elektron berikutnya. Hal ini disebabkan oleh kedekatan elektron dengan inti atom, yang mengakibatkan gaya tarik-menarik antara inti atom dan elektron semakin kuat.
5. Golongan VIIIA Memiliki Energi Ionisasi Tertinggi
Unsur golongan VIIIA memiliki energi ionisasi pertama yang paling tinggi dibandingkan dengan golongan unsur lainnya. Hal ini disebabkan oleh kestabilan konfigurasi elektron pada kulit terluar atom golongan VIIIA.
Atom-atom dalam golongan ini memiliki konfigurasi elektron yang penuh, khususnya 8 elektron valensi. Oleh karena itu, untuk mengeluarkan elektron valensi dari atom-atom golongan VIIIA, diperlukan EI yang sangat tinggi.
Pemahaman terhadap pola energi ini penting dalam memahami sifat-sifat kimia unsur dan memprediksi perilaku reaktif mereka.
Dengan mempelajari grafik EI, kita dapat mengidentifikasi pola dan tren dalam sifat-sifat ionisasi unsur. Ini memberikan wawasan penting dalam kestabilan ion, sifat reaktif, dan kemungkinan pembentukan ikatan kimia.
6. Pengecualian pada Transisi dalam Periode dan Golongan:
Dalam beberapa kasus, terdapat pengecualian dari kecenderungan di atas. Pada transisi dalam periode, terutama pada penyeberangan dari satu subkulit ke subkulit lain yang memiliki konfigurasi elektron yang stabil, terkadang energi ionisasinya dapat berkurang atau stabil.
Hal ini terjadi karena adanya efek pengecualian elektron yang membuat struktur elektron menjadi lebih stabil, sehingga EI menjadi lebih rendah.
Contoh Soal
Setelah membaca penjelasan lengkap di atas, mari kita berlatih terlebih dahulu untuk mengukur pemahaman mengenai materi ini.
1. Contoh Soal 1
Bandingkan energi ionisasi pertama antara unsur nitrogen (N) dan fosforus (P) berdasarkan posisi mereka dalam tabel periodik.
Jawaban:
Energi ionisasi pertama nitrogen (N) lebih besar daripada fosforus (P) karena nitrogen memiliki kulit elektron valensi yang lebih dekat dengan inti atom, sehingga gaya tarik-menarik antara inti atom dan elektron valensi lebih kuat.
2. Contoh Soal 2
Jelaskan mengapa unsur golongan VIIA memiliki EI-1 yang lebih tinggi dibandingkan dengan unsur golongan IIA.
Jawaban:
Unsur golongan VIIA memiliki EI-1 yang lebih tinggi karena atom-atom dalam golongan tersebut memiliki kecenderungan untuk mendapatkan satu elektron lagi agar mencapai konfigurasi elektron gas mulia yang stabil.
Dalam hal ini, EI-1 berfungsi untuk melepaskan satu elektron valensi, sementara unsur golongan IIA cenderung melepaskan dua elektron valensi, sehingga energi ionisasinya lebih rendah.
3. Contoh Soal 3
Tentukan elemen yang memiliki EI-1 paling rendah di antara unsur-unsur berikut: litium (Li), natrium (Na), kalium (K).
Jawaban:
Litium (Li) memiliki energi ionisasi pertama paling rendah di antara unsur-unsur tersebut.
Sudah Paham Penjelasan Lengkap Energi Ionisasi?
Energi ionisasi adalah konsep penting dalam kimia yang mempelajari proses penghapusan elektron dari sebuah atom atau ion. Dengan memahami energi ini, kita dapat mengenali pola dan tren dalam sifat-sifat ionisasi unsur. Artikel ini telah memberikan penjelasan lengkap mengenai energi ionisasi, termasuk cara menghitungnya dan bagaimana grafik energi ionisasi dapat digunakan untuk menganalisis sifat-sifat unsur. Semoga bermanfaat!