Hukum Avogadro, salah satu konsep penting dalam kimia yang menyatakan bahwa jumlah molekul, atom, atau partikel dalam satu mol materi tertentu akan selalu sama, yaitu sekitar 6,022 x 10²³. Hukum ini ditemukan oleh ilmuwan Italia bernama Amedeo Avogadro pada abad ke-19.
Konsep ini memiliki dampak besar dalam perhitungan stoikiometri dan pemahaman tentang hubungan antara massa, volume, dan jumlah partikel dalam kimia. Artikel ini akan menjelaskan lebih lanjut tentang bunyi Hukum Avogadro, rumusnya, serta memberikan contoh soal dan pembahasannya.
Sejarah Hukum Avogadro
Pada tahun 1811, Amedeo Avogadro mengemukakan ide yang terabaikan oleh banyak orang saat itu. Akhirnya, ide ini terbukti benar dan mengenalnya sebagai Hukum Avogadro, yang merupakan dasar dalam ilmu gas.
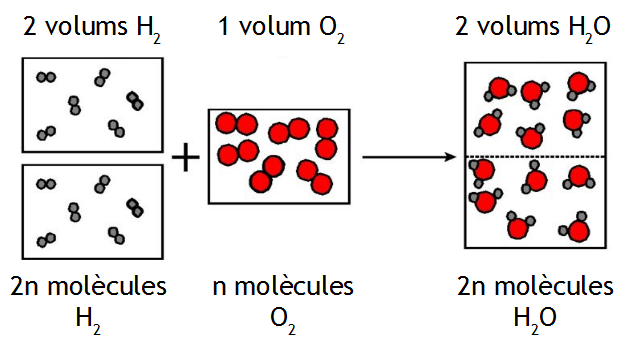
Kontribusi Avogadro, seorang ilmuwan Italia (1776-1856), terkait dengan penelitian dua ilmuwan lain pada masanya, Joseph Louis Gay-Lussac dan John Dalton. Hukum penggabungan volume Gay-Lussac (1808) mengatakan ketika dua gas bereaksi, volume reaktan dan produknya akan memiliki perbandingan bilangan bulat.
Hukum tersebut mendukung teori atom yang diusulkan oleh Dalton, meskipun Dalton sendiri menolak hasil penelitian Gay-Lussac. Avogadro, di sisi lain, melihatnya sebagai kunci untuk memahami lebih baik struktur molekul.
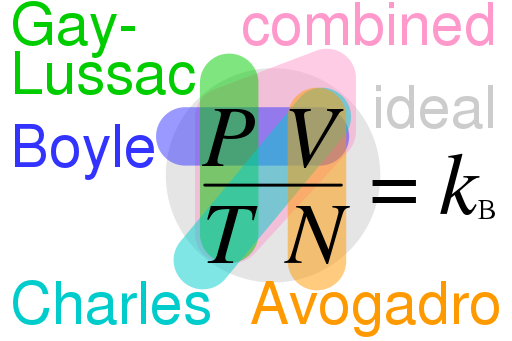
Avogadro membuat hipotesis bahwa jika kita memiliki volume gas yang sama pada suhu dan tekanan yang sama, maka jumlah molekul di dalamnya juga akan sama. Dari hipotesis ini, ia menyimpulkan berat molekul relatif dua gas bisa terhitung berdasarkan rasio kepadatan keduanya pada kondisi suhu dan tekanan yang sama.
Avogadro juga menyatakan bahwa gas sederhana bukan terdiri dari atom tunggal, melainkan molekul yang terbuat dari dua atau lebih atom. Walaupun ia tidak menggunakan kata “atom” seperti yang kita kenal sekarang, ia berbicara tentang “molekul” termasuk “molekul elementer” yang sekarang kita sebut atom.
Namun, hipotesis Avogadro terabaikan selama beberapa puluh tahun setelah ia pertama kali mengemukannya. Ada beberapa alasan untuk ini, termasuk masalah teoritis seperti pandangan “dualisme” oleh Jöns Jakob Berzelius, yang menyatakan bahwa senyawa disatukan oleh daya tarik antara muatan listrik positif dan negatif.
Oleh karena itu, sulit untuk membayangkan bahwa molekul yang terdiri dari dua atom yang memiliki muatan serupa, seperti oksigen, bisa ada. Selain itu, Avogadro bukan bagian dari komunitas ilmuwan kimia yang aktif pada masanya, dan Italia tidak menjadi pusat perhatian kimia seperti Prancis, Jerman, Inggris, dan Swedia.
Bunyi Hukum Avogadro
Dalam konteks modern, Hukum Avogadro menjelaskan tentang sifat dasar gas dan bagaimana gas berinteraksi dengan lingkungan sekitarnya. Konsep utama dalam hukum ini adalah jika kita memiliki sejumlah gas pada suhu dan tekanan yang tetap, maka jumlah mol gas akan berbanding lurus dengan volumenya.
Artinya, jika kita menggandakan jumlah mol gas yang kita miliki, maka volume gasnya juga akan menggandakan. Hal ini berlaku untuk gas tertentu, dan itu adalah ide dasar dalam kimia gas.
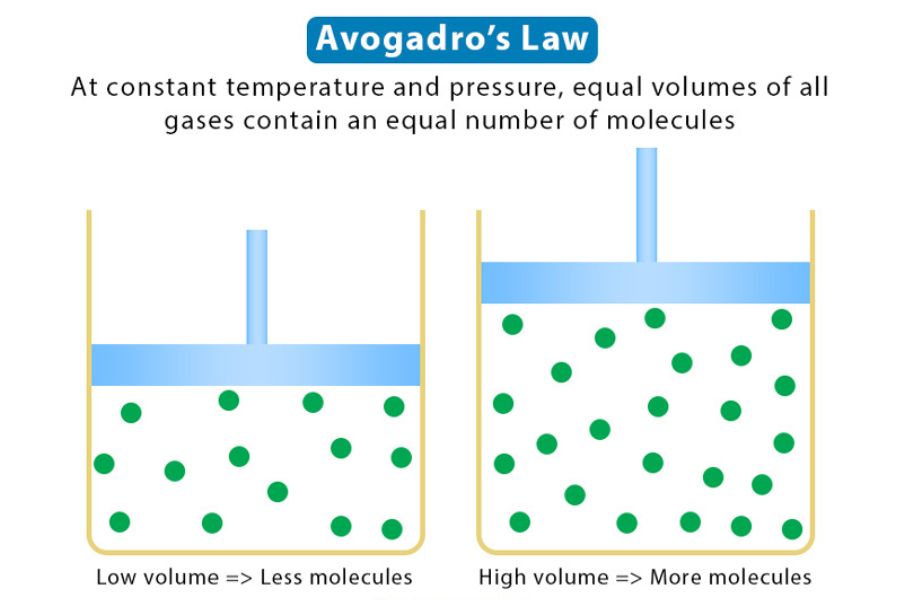
Penting untuk Anda pahami bahwa Hukum Avogadro sangat berkaitan dengan persamaan gas ideal. Persamaan gas ideal menyediakan kerangka kerja matematis yang memungkinkan kita untuk menggambarkan perilaku gas dengan lebih detail.
Persamaan ini mencakup variabel seperti tekanan, volume, jumlah mol gas, dan konstanta gas. Dengan menggunakan persamaan gas ideal, kita dapat melakukan perhitungan yang kompleks terkait dengan gas dalam berbagai kondisi.
Dalam pemahaman gas ideal, kita menganggap partikel-partikel gas sebagai entitas yang sangat kecil, bahkan hampir tanpa massa, dan tidak saling menarik satu sama lain. Partikel ini hanya bergerak secara acak dan mengalami tumbukan dengan dinding wadah tempatnya berada.
Namun, perlu Anda ingat pula bahwa dalam dunia nyata, gas tidak selalu ideal. Ada situasi di mana interaksi antara partikel gas menjadi signifikan, terutama pada tekanan dan suhu yang sangat rendah atau sangat tinggi.
Meskipun demikian, dalam kondisi sebagian besar yang kita temui sehari-hari, perilaku gas hampir selalu mendekati keadaan ideal. Oleh karena itu, Hukum Avogadro dan konsep gas ideal tetap menjadi landasan yang sangat penting dalam kimia dan ilmu pengetahuan terkait.
Rumus Hukum Avogadro
Menurut aturan Avogadro, volume gas (V) berbanding terbalik dengan jumlah partikelnya (n). Hal ini dapat tergambarkan secara matematis sebagai berikut:
V ∝ n
Ahli kimia menggunakan jumlah mol untuk menentukan jumlah atom dan molekul. Jumlah partikel yang membentuk satu mol zat yang mengenalnya sebagai bilangan Avogadro atau Avogadro’s number (NA). Telah ditetapkan melalui berbagai penelitian bahwa NA memiliki kerapatan partikel per mol 6,02 × 10²³.
Dengan kata lain, volume (V) dengan jumlah partikel gas (n) rasionya sama dengan konstanta proporsional (k).
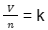
Sehingga,
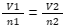
Persamaan ini mengatakan bahwa ketika jumlah partikel dalam gas berubah dari n1 ke n2, maka volumenya juga berubah dari V1 ke V2. Persamaan ini juga dikenal sebagai derivasi atau penurunan rumus Hukum Avogadro. Nah, persamaan gas ideal di bawah ini dapat berguna untuk mengetahui Hukum Avogadro:
P x V = n x R x T
Keterangannya:
- P = tekanan yang diberikan gas pada dinding wadahnya
- V = volume yang diambil gas
- n = jumlah mol gas
- R= konstanta gas
- T= suhu absolut
Jika Anda mengatur ulang persamaan untuk gas ideal, maka Anda akan mendapatkan persamaan berikut:
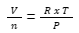
Dalam rumus tersebut, nilai sebelah kanannya adalah konstan. Kemudian:
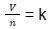
Sehingga, hubungan antara jumlah ruang yang dibutuhkan gas dan jumlah molekul dalam gas telah terbukti.
Contoh Soal Terkait Hukum Avogadro dan Pembahasannya

Berikut ini adalah beberapa contoh soal yang menerapkan aturan Avogadro:
1. Contoh Soal Mengenai Wadah yang Berisi Gas
Pada suhu 25° C dan tekanan 2,00 atm, ada sebuah wadah berisi 6,0 liter gas dengan 0,5 mol. Jika Anda menambahkan 0,25 mol gas tambahan pada suhu dan tekanan yang sama, berapa volume totalnya?
Pembahasan:
Volume awal (V1) = 6,0 liter
Jumlah mol awal (n1) = 0,5 mol
Tekanan dan suhu tetap konstan
Jumlah akhir mol (n2) = 0,5 + 0,25 = 0,75 mol

Kemudian, ganti nilai dengan yang Anda ketahui ke dalam persamaan dan selesaikan untuk V2:
6,0 liter × 0,5 mol = V2 × 0,75 mol
V2 = (6,0 liter × 0,5 mol) / 0,75 mol
V2 = 4,0 liter
Jadi, ketika Anda menambahkan 0,25 mol gas tambahan pada suhu dan tekanan yang sama, maka volume totalnya menjadi 4,0 liter.
2. Contoh Soal Tentang Balon Isi Gas Helium
Ada sebuah balon yang awalnya berisi 0,0920 mol gas helium dan memiliki volume 1,90 liter. Kemudian, tambahan 0,0210 mol gas helium dimasukkan ke dalam balon tanpa mengubah suhu dan tekanan. Berapa volume balon setelah penambahan gas helium?
Pembahasan:
Volume awal (V1) = 1,90 liter
Jumlah mol awal (n1) = 0,0920 mol
Jumlah mol helium tambahan (n2) = 0,0920 + 0,0210 = 0,1130 mol
Anda tahu bahwa Anda perlu menggunakan Hukum Avogadro untuk mencari volume akhir. Sehingga, pertama-tama Anda akan menggunakan persamaan berikut untuk mencari volume akhir (V2):
V2 = V1 × (n2 / n1)
Sekarang, Anda akan menggantikan nilai yang Anda tahu ke dalam persamaan dan menyelesaikannya:
V2 = 1,90 liter × (0,1130 mol / 0,0920 mol) = 2,33 liter
Jadi, setelah menambahkan sedikit gas helium tambahan, volume balon meningkat menjadi 2,33 liter.
3. Soal Mengenai Banyak Udara yang Tersisa di dalam Ban
Ketika Anda mengeluarkan setengah dari volume ban udara yang awalnya 40 liter dengan 10 mol udara, berapa banyak udara yang masih tersisa di dalam ban yang sudah kempes?
Pembahasan:
Volume awal (V1) = 40 liter
Jumlah awal mol (n1) = 10 mol
Setengah dari volume awal dihilangkan, sehingga volume akhir (V2) = 20 liter
Jumlah akhir mol (n2) = x mol (yang ingin kita temukan)
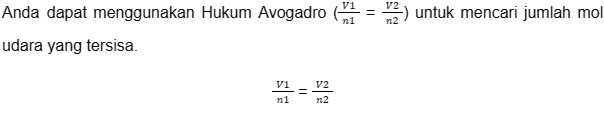
Kemudian, Anda ganti nilai yang Anda ketahui ke dalam persamaan dan selesaikan untuk n2 (jumlah mol yang tersisa):
40 liter / 10 mol = 20 liter / n2
4 = 20 / n2
n2 = 20 / 4
n2 = 5 mol
Jadi, setelah mengeluarkan setengah dari volume ban, masih ada 5 mol udara di dalamnya.
Sudahkan Paham Tentang Hukum Avogadro?
Dalam kesimpulannya, Hukum Avogadro memainkan peran penting dalam memahami hubungan antara volume, jumlah mol, dan gas. Konsep ini memungkinkan Anda untuk menghitung perubahan dalam sistem gas dalam berbagai kondisi.
Ketika menerapkan dengan benar, hukum ini memberikan wawasan yang berharga dalam kimia dan ilmu pengetahuan terkait, membantu Anda memahami perilaku gas dalam berbagai situasi.Pemahaman yang kuat tentang Hukum Avogadro juga memiliki implikasi praktis yang signifikan dalam berbagai industri, termasuk kimia, farmasi, dan manufaktur. Dengan menerapkan konsep ini, para ilmuwan dan insinyur dapat mengontrol kualitas bahan kimia dan mengembangkan teknologi baru.

