Mungkin Anda akan sering mendengar istilah rumus empiris dan rumus molekul ketika membahas ilmu senyawa kimia. Kedua istilah ini memiliki peranan penting dalam mengidentifikasi komposisi kimia suatu senyawa.
Namun, apakah Anda tahu apa perbedaan diantara keduanya? Selain itu, bagaimana cara menentukan nilai empiris dan nilai molekul suatu senyawa? Artikel ini akan membahas secara mendalam mengenai kedua rumus tersebut dalam suatu senyawa.
Konsep dan Perbedaan Rumus Empiris dan Rumus Molekul
Rumus empiris dan rumus molekul merupakan dua konsep penting dalam kimia yang berguna untuk mewakili komposisi kimia suatu senyawa. Mari kita menyelami konsep keduanya beserta perbedaannya pada penjelasan di bawah ini:
1. Konsep Rumus Empiris
Rumus empiris adalah bentuk sederhana dari komposisi suatu senyawa kimia yang menunjukkan perbandingan relatif atom-atom dalam senyawa tersebut, tetapi tidak memberikan informasi tentang jumlah sebenarnya dari atom-atom tersebut.
Artinya, Anda bisa melihat perbandingan jumlah atom masing-masing unsur dalam senyawa, yang dapat menjadi sub-kelipatan atau sama dengan rumus molekul senyawa tersebut. Tetapi tidak tentang bagaimana atom-atom tersebut diatur dalam struktur molekul.
2. Konsep Rumus Molekul
Sementara rumus molekul adalah bentuk rumus kimia yang lebih rinci dan menunjukkan jumlah sebenarnya dari masing-masing atom dalam suatu molekul senyawa. Jadi, rumus molekul memberikan gambaran tentang komposisi molekul suatu senyawa secara spesifik.
Rumus molekul memberikan gambaran lebih rinci tentang komposisi senyawa daripada rumus empiris, yang mungkin hanya menggambarkan rasio atom dalam senyawa. Dengan kata lain, rumus molekul menunjukkan banyaknya atom dalam satu molekul senyawa, sehingga lebih spesifik daripada rumus empiris.
3. Perbedaan Rumus Empiris dan Rumus Molekul Beserta Contohnya
Berdasarkan pengertiannya di atas, perbedaan utama antara kedua rumus kimia ini adalah tingkat rincian yang keduanya berikan tentang komposisi senyawa.
Rumus empiris memberikan informasi tentang perbandingan relatif jumlah atom dalam senyawa atau bentuk paling sederhana dari rumus kimia suatu senyawa. Sedangkan rumus molekul memberikan informasi tentang jumlah sebenarnya atom-atom dalam satu molekul senyawa.
Sebagai contoh, glukosa memiliki rumus molekul C₆H₁₂O₆, sedangkan rumus empirisnya adalah CH₂O. Oleh sebab itu, empiris glukosa menunjukkan perbandingan relatif yang sederhana dari rumus molekul.
Tahapan Menentukan Rumus Empiris dan Rumus Molekul Senyawa

Menentukan rumus empiris dan rumus molekul suatu senyawa adalah langkah penting dalam kimia untuk memahami komposisi kimia suatu zat. Berikut adalah cara-cara untuk menentukan kedua jenis rumus ini:
1. Langkah Menentukan Rumus Empiris Senyawa
Pertama, langkah-langkah untuk menentukan rumus empiris suatu senyawa adalah sebagai berikut:
- Identifikasi unsur-unsur yang terkandung dalam senyawa kimia.
- Lalu, tentukan jumlah atom tiap unsur dalam senyawa berdasarkan informasi yang diberikan.
- Kemudian, reduksi perbandingan jumlah atom tiap unsur untuk mendapatkan rasio atom terkecil dengan cara membagikan jumlah mol tiap unsur dengan FPB (Faktor Persekutuan Terbesar) mol seluruh unsur atau dengan mol unsur terkecil.
2. Langkah Menentukan Rumus Molekul Suatu Senyawa
Sementara itu, langkah-langkah untuk menentukan rumus molekul suatu senyawa adalah sebagai berikut:
- Pertama, tentukan rumus empiris menggunakan langkah-langkah di atas.
- Lalu, hitung massa molar rumus empiris menggunakan massa molar tiap unsur dalam rumus empirisnya.
- Kemudian, tentukan massa molar senyawa yang sebenarnya dengan menggunakan teknik analitik seperti spektrometri massa atau analisis unsur.
- Selanjutnya, tentukan faktor kelipatan dengan membagi massa molar senyawa dengan massa molar rumus empiris untuk mendapatkan faktor kelipatan.
- Terakhir, hitung rumus molekul dengan mengalikan rumus empiris dengan faktor kelipatan.
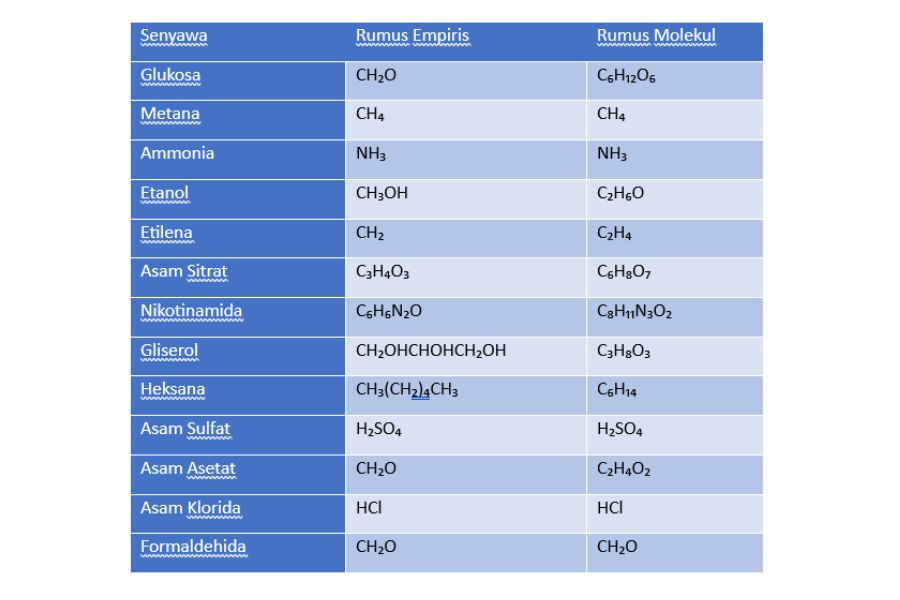
Contoh Rumus Empiris dan Rumus Molekul Berbagai Senyawa
Simak tabel di bawah ini yang memberikan beberapa contoh rumus empiris dan rumus molekul dari sejumlah senyawa:
Contoh Soal dan Pembahasan
Nah, untuk memperdalam pengetahuan Anda, praktikkan penentuan rumus empiris dan rumus molekul di atas dengan beberapa contoh soal yang menarik berikut ini:
1. Contoh Soal 1
Sebuah senyawa mengandung 40% karbon (C), 6,7% hidrogen (H), dan sisanya oksigen (O). Tentukan rumus empiris dari senyawa tersebut!
Pembahasan:
Mulai dengan mengasumsikan bahwa Anda memiliki 100 gram senyawa. Asumsi akan mempermudah perhitungan, karena persentase berubah menjadi gram. Kemudian, hitung jumlah mol tiap unsur dalam senyawa:
- Karbon (C)
Mol C = Persentase berat : Massa molar
Mol C = 40% : 12 g/mol =3,33 mol
- Hidrogen (H)
Mol H = 6,7% : 1 g/mol = 6,7 mol
- Oksigen (O)
Karena massa oksigen dapat dihitung dengan selisih dari total massa, maka massa oksigen adalah 100 g − (40 g + 6,7 g) = 53,3 g
Mol = 53,3 g : (16 g/mol) = 3,33 mol
Setelah itu, bagi jumlah mol tiap unsur dengan jumlah mol terkecil:
- Karbon (C) = 3,33 mol : 3,33 mol = 1
- Hidrogen (H) = 6,7 mol : 3,33 mol ≈ 2
- Oksigen (O) = 3,33 mol : 3,33 mol = 1
Sehingga, rumus empiris senyawa ini adalah CH₂O.
2. Contoh Soal 2
Tentukan rumus molekul dari sebuah senyawa yang memiliki rumus empiris CH₂O dan berat molekul relatif (Mr) senyawa sebesar 60 g/mol!
Pembahasan:
Pertama, tentukan jumlah masing-masing unsur dalam rumus empiris:
- Karbon (C) = 1 atom
- Hidrogen (H) = 2 atom
- Oksigen (O) = 1 atom
Lalu, hitung jumlah total massa atom dalam rumus empiris:
- Karbon (C) = 12 g/mol x 1 atom = 12 g/mol
- Hidrogen (H) = 1 g/mol x 2 atom = 2 g/mol
- Oksigen (O) = 16 g/mol x 1 atom = 16 g/mol
Total massa atom dalam rumus empiris = 12 g/mol + 2 g/mol + 16 g/mol = 30 g/mol.
Kemudian, tentukan faktor pengali untuk mendapatkan rumus molekul:
Mr senyawa = 60 g/mol (berat molekul relatif yang diberikan dalam soal)
Faktor pengali = Mr senyawa : Total massa atom dalam rumus empiris
Faktor pengali = 60 g/mol : 30 g/mol = 2
Terakhir, kalikan setiap simbol unsur dalam rumus empiris dengan faktor pengali:
- Karbon (C) = 1 x 2 = 2
- Hidrogen (H) = 2 x 2 = 4
- Oksigen (O) = 1 x 2 = 2
Sehingga, rumus molekul dari senyawa tersebut adalah C₂H₄O₂.
3. Contoh Soal 3
Suatu senyawa organik mengandung 40% karbon (C), 6,7% hidrogen (H), dan sisanya adalah nitrogen (N). Berat molekul relatif (Mr) senyawa tersebut adalah 90 g/mol. Tentukan masing-masing rumus empiris dan rumus molekul dari senyawa tersebut!
Pembahasan:
a. Rumus Empiris
Mula-mula, ubah persentase menjadi gram:
- Karbon (C) = 40% dari 100 gram = 40 gram
- Hidrogen (H) = 6.7% dari 100 gram = 6.7 gram
- Sisa senyawa Nitrogen (N) = 100 gram – (40 gram + 6.7 gram) = 53.3 gram
Kemudian, tentukan jumlah mol untuk masing-masing unsur:
- C = 40 gram : 12 g/mol = 3.33 mol
- H = 6.7 gram : 1 g/mol = 6.7 mol
- N = 53.3 gram : 14 g/mol = 3.81 mol
Lalu, bagikan jumlah mol dari masing-masing unsur dengan jumlah mol terkecil untuk menentukan rasio sederhana antara jumlah atom unsur dalam rumus empiris:
- C = 3.33 mol : 3.33 mol = 1
- H = 6.7 mol : 3.33 mol ≈ 2 (dibulatkan)
- N = 3.81 mol : 3.33 mol ≈ 1.14, dibulatkan menjadi 1
b. Rumus Molekul
Selanjutnya, untuk mencari rumus molekul, hitung jumlah total massa atom dalam rumus empiris:
- C = 12 g/mol x 1 atom = 12 g/mol
- H = 1 g/mol x 2 atom = 2 g/mol
- N = 14 g/mol x 1 atom = 14 g/mol
Total = 12g/mol + 2g/mol +14 g/mol = 28 g/mol
Lalu, tentukan faktor pengali untuk mendapatkan rumus molekul:
- Mr senyawa = 90 g/mol
- Faktor pengali = Mr senyawa : Total massa atom
- Faktor pengali = (90 g/mol) : (28 g/mol) ≈ 3 (dibulatkan)
Terakhir, kalikan setiap simbol unsur dalam rumus empiris dengan faktor pengali:
- C = 1 x 3 = 3
- H = 2 x 3 = 6
- N = 1 x 3 = 3
Jadi, rumus empiris dan rumus molekul dari senyawa tersebut adalah CH₂N dan C₃H₆N₃.
Sudah Paham dengan Rumus Empiris dan Rumus Molekul?
Itulah penjelasan singkat tentang rumus empiris dan rumus molekul yang perlu Anda pahami. Kesimpulannya, rumus empiris memberikan informasi tentang perbandingan tiap komponen senyawa. Sementara rumus molekul memberikan gambaran jumlah sebenarnya atom-atom dalam senyawa tersebut.
Kedua jenis rumus ini digunakan secara bersamaan dalam analisis kimia yang lebih mendalam. Memahami rumus-rumus ini tidak hanya cukup dengan menghafalkan tahapannya. Anda perlu berlatih soal setiap hari agar Anda terbiasa dengan berbagai macam studi kasus terkait rumus-rumus tersebut.