Hidrolisis garam adalah salah satu konsep penting dalam bidang ilmu kimia yang memahami bagaimana garam dapat bereaksi dengan air untuk menghasilkan larutan yang bersifat asam atau basa. Konsep ini memiliki aplikasi luas dan memiliki peran penting dalam banyak aspek kehidupan sehari-hari.
Artikel ini akan membantu Anda memahami konsep hidrolisis secara mendalam dan akan membongkar secara tuntas contoh soal beserta pembahasannya. Tentunya, jangan lewatkan untuk terus membaca.
Daftar ISI
Apa Itu Hidrolisis Garam?
Garam adalah senyawa yang terbentuk dari reaksi netralisasi asam dan basa. Umumnya, garam terionisasi dalam kation dan anion yang menyediakan air. Sedangkan proses reaksi kimia antara kation atau anion garam dan air dikenal sebagai hidrolisis garam.
Proses hidrolisis garam adalah kebalikan dari netralisasi. Kation dan anion yang terbentuk selama ionisasi garam dalam larutan air sebagai ion akan terhidrasi atau berinteraksi dengan air, berguna untuk meregenerasi asam dan basa.
Hasilnya, larutan dapat mengalami perubahan pH, baik itu menjadi lebih asam, lebih basa, atau netral, tergantung pada sifat-sifat kimia garam tersebut. Begini persamaannya:
Garam + Air = Asam + Basa
Anda juga dapat menulis prosesnya menjadi:
BA + H2O = HA + BOH
Semua garam adalah elektrolit kuat. Dengan demikian, garam akan terionisasi sepenuhnya dalam larutan air. Apabila produk dari reaksi adalah asam kuat dan basa lemah, maka reaksi hidrolisis menjadi:
B + A– +H+2O = H + A– + BOH+ atau B + H+2O = H + BOH+
Dalam reaksi tersebut, kation bereaksi dengan air untuk menghasilkan larutan asam. Proses ini adalah hidrolisis kationik. Namun, apabila hidrolisis garam menghasilkan asam lemah dan basa kuat, maka persamaan reaksi akan menjadi:
B + A– + H+2O = HA + B + OH– atau A– +H2O = HA + OH–
Oleh karena itu, anion bereaksi dengan air untuk menghasilkan larutan dasar dan disebut hidrolisis anionik.
Jenis-Jenis Garam Berdasarkan Proses Hidrolisis

Berdasarkan proses hidrolisis, garam dapat terbagi menjadi beberapa jenis, tergantung pada sifat asam dan basa yang digunakan dalam pembentukannya. Berikut adalah beberapa jenisnya:
1. Garam Asam Kuat dan Basa Kuat
Garam yang terbentuk dari proses netralisasi antara asam kuat dan basa kuat akan bersifat netral karena ikatan dalam larutan garam tidak akan pecah. Umumnya, garam tersebut terhidrasi tetapi tidak terhidrolisis. Contoh jenis garam ini adalah NaCl, K₂SO₄, NaNO₃, dan lain-lain.
2. Garam Asam Lemah dan Basa Kuat
Kemudian, garam yang terbentuk dari proses netralisasi antara asam lemah dan basa kuat akan bersifat basa. Misalnya: CH₃COONa, NaCN, NaHCO₃, Na₂CO₃, dan lain-lain. Begini persamaannya:
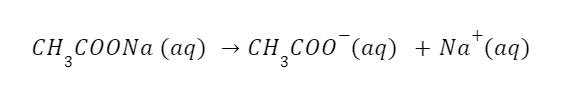
Dalam persamaan tersebut, ion asetat yang terbentuk mengalami hidrolisis garam dan membentuk asam asetat dan ion OH⁻. Sehingga, persamaannya menjadi:
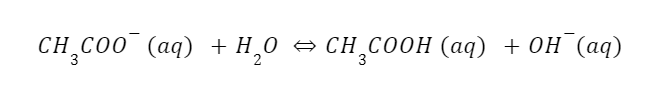
Seperti yang Anda ketahui, asam asetat adalah asam lemah. Namun, asam asetat tetap bersatu dalam larutan. Proses tersebut menghasilkan peningkatan konsentrasi ion OH⁻ yang membentuk larutan basa dengan pH larutan lebih dari 7 (pH > 7).
3. Garam Asam Kuat dan Basa Lemah
Garam yang terbentuk dari proses netralisasi antara asam kuat dan basa lemah akan bersifat asam. Contohnya NH4Cl, FeCL₃, CuCl₂, AlCl₃, CuSO₄, dan lain-lain. Begini persamaannya:
NH4Cl (aq) = Cl–(aq) + NH4+ (aq)
Ion amonium yang terbentuk mengalami hidrolisis garam untuk membentuk amonium hidroksida dan ion H⁺. Sehingga, persamaannya menjadi:
NH4+ (aq) + H2O = NH4OH (aq) + H+ (aq)
Amonium hidroksida adalah basa lemah, senyawa tersebut tetap bersatu dalam larutan. Sehingga, larutan menghasilkan peningkatan konsentrasi ion H⁺ yang membuat larutan bersifat asam atau larutan yang memiliki pH kurang dari 7 (pH < 7).
4. Garam Asam Lemah dan Basa Lemah
Terakhir, garam yang terbentuk dari proses netralisasi antara asam lemah dan basa lemah dapat bersifat asam, basa, atau netral. Sifat asam dan basa yang terlibat dapat menentukan sifat hasilnya. Sebagai contoh adalah CH3COONH4, (NH₄)₂CO₃, NH₄CO₃, dan lain-lain.
Mekanisme umum untuk hidrolisis garam dari ion yang terbentuk dari garam-garam ini adalah sebagai berikut:
CH3COO– + NH4++ H2O = CH3COOH + NH4OH
Faktor-Faktor yang Mempengaruhi Hidrolisis Garam
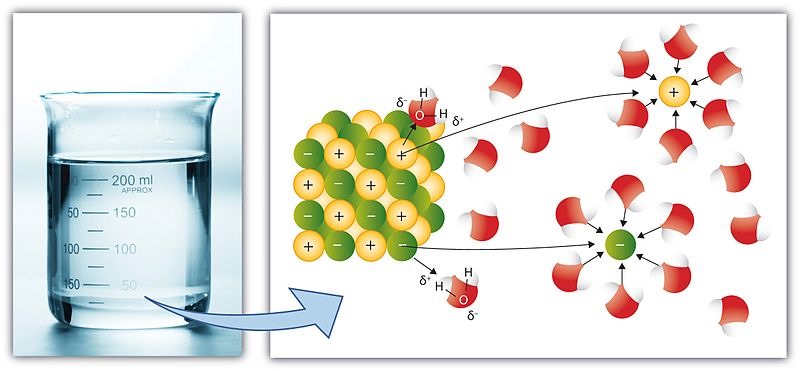
Terdapat beberapa faktor yang dapat mempengaruhi tingkat hidrolisis garam. Diantaranya adalah:
1. Konsentrasi Garam
Pada konsentrasi yang rendah, efek hidrolisis mungkin tidak terlalu mencolok. Namun, semakin besar konsentrasi garam dalam larutan, semakin besar jumlah ion yang dihasilkan dan semakin jelas efek hidrolisisnya yang mana dapat mempengaruhi pH larutan.
2. Sifat Asam dan Basa Asal
Sifat asam dan basa asal yang membentuk garam memiliki peran penting dalam hidrolisis garam. Asam kuat dan basa kuat (seperti NaCl) lebih cenderung menghasilkan larutan bersifat netral.
Namun, garam yang berasal dari asam lemah dan basa kuat (seperti CH3COONa) akan menghasilkan larutan sedikit basa. Sebaliknya, garam yang berasal dari asam kuat dan basa lemah (seperti Na2CO3) akan menghasilkan larutan sedikit asam.
3. Suhu
Suhu juga dapat mempengaruhi tingkat hidrolisis. Dalam beberapa kasus, suhu tinggi dapat meningkatkan laju hidrolisis, meskipun efeknya mungkin bervariasi tergantung pada garam-garam yang terlibat.
Rumus Hidrolisis Garam

Konstanta hidrolisis (atau konstanta hidrolitik) adalah konstanta kesetimbangan yang diperoleh dengan menerapkan hukum aksi massa pada reaksi hidrolisis, dan tertulis sebagai Kh.
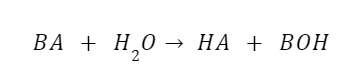
Berdasarkan hukum aksi massa, konstanta kesetimbangannya adalah:
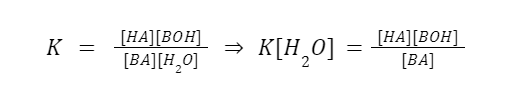
Berhubung dalam larutan tersebut terdapat banyak senyawa air, maka konsentrasinya diasumsikan konstan.
K[H2O] = konstan = Kh
Fraksi (atau persentase) total garam yang terhidrolisis dikenal sebagai derajat atau tingkat hidrolisis garam. Misalnya, jika ada larutan garam yang mengalami hidrolisis sebanyak 50 persen, maka derajat hidrolisisnya adalah 50 persen. Tingkat ini terwakilkan dengan simbol ‘h’.

Rumus untuk hidrolisis berdasarkan jenis-jenisnya dapat dirangkum sebagai berikut:
- Garam Asam Lemah dan Basa Kuat
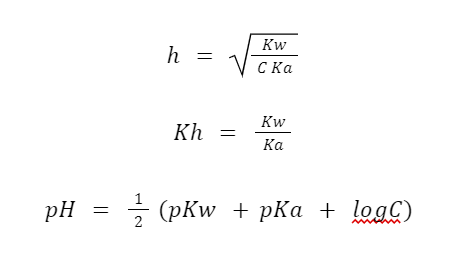
- Garam Asam Kuat dan Basa Lemah
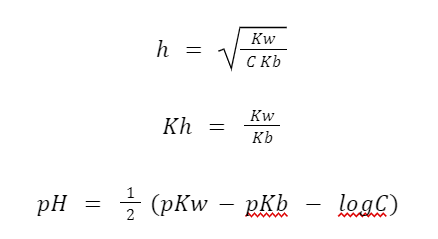
- Garam Asam Kuat dan Basa Lemah
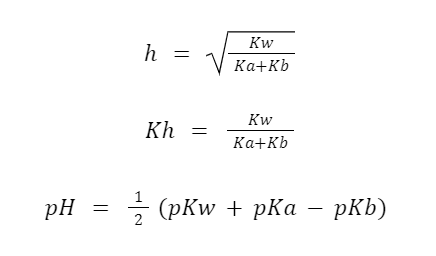
Sehingga, dalam kasus di mana garam bersifat asam lemah atau basa lemah, maka sifat-sifatnya dapat ditentukan dengan cara berikut:
- Jika Ka = Kb, maka larutan bersifat netral.
- Jika Ka > Kb, maka larutan bersifat asam.
- Sedangkan jika Ka < Kb, maka larutan bersifat basa.
Untuk hubungan antara Ka dan Kb dengan pKa dan pKb adalah:
Ka x Kb = Kw
pKa + pKb = pKw
Contoh Soal Hidrolisis Garam dengan Pembahasan
Untuk memahami konsep hidrolisis garam dengan lebih baik, mari lihat beberapa contoh soal yang melibatkan proses hidrolisis berikut ini:
1. Contoh Soal 1
Manakah dari garam-garam di bawah ini yang mengalami proses hidrolisis kationik?
- NaH2PO4
- CH3COONa
- GaCl3
- Li2CO3
Pembahasan:
Hidrolisis kationik terjadi pada garam asam kuat dan basa lemah. Karena GaCl3 adalah garam dari kedua basa lemah (Ga(OH)3) dan asam kuat (HCl), maka garam tersebut akan mengalami hidrolisis kationik.
2. Contoh Soal 2
Hitung persentase hidrolisis garam dalam 10⁻² M larutan dari NaCN (Ka = 6,2 x 10⁻¹⁰)
Pembahasan:
NaCN adalah garam asam lemah (HCN) dan basa kuat (NaOH). Tingkat hidrolisisnya dapat Anda hitung dengan menggunakan rumus berikut:
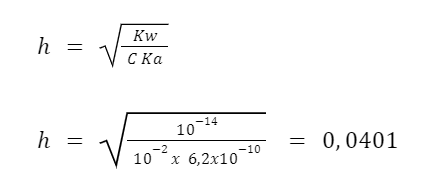
Kemudian persentase hidrolisisnya bisa Anda dapatkan dengan 0,0401 x 100%. Sehingga, persentase tingkat hidrolisisnya adalah 4%.
3. Contoh Soal 3
Konstanta ionisasi asam Zn⁺² adalah 2 × 10⁻¹⁰. Berapa pH larutan 0,001 M ZnCl₂?
Pembahasan:

Sudah Paham dengan Konsep Hidrolisis Garam?
Sebagai kesimpulan, hidrolisis garam adalah konsep penting dalam bidang ilmu kimia. Dasar ilmu ini menggambarkan bagaimana garam dapat bereaksi dengan air untuk menghasilkan larutan yang bersifat asam atau basa.
Terdapat empat jenis hidrolisis ini, yaitu hidrolisis dengan garam bersifat asam kuat-basa kuat, asam kuat-basa lemah, asam lemah-basa kuat, dan asam lemah-basa lemah. Berkat fenomena ini, Anda dapat memengaruhi pH dalam ekosistem air, seperti sungai, danau, dan laut.
Dengan menguasai konsep ini, Anda akan memiliki pemahaman yang lebih baik tentang sifat kimia larutan dan reaksi kimia yang terjadi dalamnya. Semoga artikel ini bermanfaat!