Ketika kamu merebus air tanpa penutup di panci, rebusan akan menghasilkan uang. Tetapi, jika panci ditutup, uap yang keluar kembali menjadi air. Rupanya kondisi tersebut merupakan reaksi kesetimbangan kimia. Mari mengupas peristiwa menarik ini lebih lanjut lewat penjelasan dalam artikel ini!
Daftar ISI
Apa Itu Kesetimbangan Kimia?
Secara definisi, kesetimbangan merupakan suatu kondisi setimbang, tidak bergerak, dan diam. Dengan kata lain, suatu kondisi di mana reaksi berjalan dua arah dengan kecepatan dan waktu yang bersamaan.
Umumnya, reaksi kimia bersifat reversible (dua arah), tetapi sebagian kecil juga ada yang bersifat irreversible (satu arah). Reaksi reversible terjadi ketika pembentukan suatu produk ke arah kanan maka, secara langsung reaksi tersebut akan kembali lagi ke kiri untuk menjadi reaktan.
Ketika proses reaksi ke kanan dan ke kiri memiliki laju dan kecepatan yang sama, maka telah tercapai suatu kesetimbangan. Dalam keadaan ini, artinya reaktan telah mencapai kondisi maksimumnya.
Mengutip dari jurnal dari Luh Joni Erawati, kesetimbangan kimia (Equilibrium Chemical) merupakan suatu reaksi yang berjalan ke arah kanan membentuk produk. Sementara itu, reaksi bergerak ke arah kiri membentuk reaktan.
Kedua reaksi tersebut memiliki laju yang sama serta konsentrasi reaktan tidak mengalami perubahan.
Faktor Apakah yang Memengaruhi Kesetimbangan?
Henry Louis, seorang ilmuwan asal Perancis yang menemukan teori kesetimbangan, berpendapat bahwa: “apabila berlangsung reaksi kesetimbangan dan dilakukan suatu aksi, maka sistem itu akan mengalami reaksi untuk mengurangi aksi tersebut”. Jadi, apa saja faktor-faktor yang memengaruhi kesetimbangan?
1. Volume
Faktor pertama yang memengaruhi kesetimbangan adalah volume antara reaktan dan produk. Jika kamu menambahkan sejumlah volume ke reaktan, maka kesetimbangan akan bergeser ke arah produk. Jika mengurangi volume reaktan, maka akan bergeser ke reaktan itu sendiri.
Meningkatkan sejumlah volume akan memengaruhi nilai koefisien reaktan atau produk. Jika volume bertambah, maka reaksi kesetimbangan bergeser ke arah koefisien yang lebih besar. Berikut ini merupakan contoh rumus reaksinya.
Ca2+ + CO3 2- CaCO3
Coba hitung, berapa jumlah koefisien reaksinya?
Koefisien reaksi sebelah kiri (reaktan) : Ca = 1
: CO3 = 1
Total = 2
Koefisien reaksi sebelah kanan (produk) : CaCO3 = 1
Kesimpulan dari contoh di atas adalah nilai koefisien reaktan lebih besar daripada produk. Jika memperbesar volume pada reaksi kalsium karbonat, maka reaksi kesetimbangan akan bergeser ke arah kiri (reaktan).
2. Tekanan
Berbeda dengan volume, jika menambahkan sejumlah tekanan dalam persamaan reaksi, maka kesetimbangan akan bergeser ke arah koefisien yang lebih kecil. Begitu sebaliknya, jika kamu memperkecil tekanan, hasilnya kesetimbangan bergeser ke koefisien lebih besar. Contohnya seperti di bawah ini.
2 CO (g) + 2 O2 (g) 2 CO2 (g)
Hitung lagi yuk, berapa nilai koefisien reaksinya?
Reaktan : CO = 2
: 02 = 2
Total = 4
Produk : CO2 = 2
Dari teori di atas, persamaan reaksi CO2 memiliki jumlah koefisien reaktan lebih besar daripada produk. Kalau kamu memperbesar tekanan, maka kesetimbangan kimia akan bergeser ke arah kanan (produk).
Perubahan tekanan hanya berlaku apabila suatu reaksi kesetimbangan melibatkan gas. Jika melibatkan zat padat (s) atau zat cair (l), konsekuensinya perubahan tekanan tidak berlaku pada reaksi tersebut.
Aturan tersebut ada karena kesetimbangan yang melibatkan zat padat dan zat cair akan menghasilkan reaksi yang padat sehingga tidak berpengaruh.
3. Konsentrasi
Konsentrasi sangat berpengaruh terhadap laju reaksi kimia. Makin besar konsentrasi suatu senyawa, laju reaksinya juga semakin cepat.
Tentunya, konsentrasi berpengaruh terhadap jumlah molekul suatu senyawa. Makin besar konsentrasinya, jumlah molekulnya bertambah sehingga jarak antar partikel lebih sedikit.
Asas Le Chatelier menunjukkan apabila terjadi perubahan konsentrasi pereaksi atau produk, kesetimbangan bergerak ke arah yang berlawanan. Misalnya, ada penambahan konsentrasi pada reaktan, hasilnya kesetimbangan bergeser ke produk, dan begitu sebaliknya.
Agar lebih mudah, perhatikan ilustrasi berikut ini.
N2 (g) + 3H2(g) 2NH3 (g)
Dengan cara yang sama, jumlah koefisien reaktan pada reaksi amonia adalah 4, sedangkan nilai koefisien produknya adalah 2. Jika konsentrasi reaktan bertambah, suatu sistem akan memperkecil aksi dalam reaktan tersebut. Akibatnya, reaksi kesetimbangan bergeser ke arah produk.
4. Temperatur atau Suhu
Pengaruh suhu dalam kesetimbangan kimia berkaitan dengan reaksi endoterm atau eksoterm. Reaksi endoterm merupakan reaksi yang terjadi dengan menyerap kalor dari lingkungan, sedangkan reaksi eksoterm merupakan reaksi yang melepaskan kalor ke lingkungan.
Dalam reaksi kesetimbangan, pasti akan ada nilai entalpi reaksi (ΔH). Reaksi eksoterm memiliki entalpi negatif, akibatnya nilai ΔH reaktan lebih besar daripada ΔH produk. Sebaliknya, reaksi endoterm memiliki entalpi produk lebih tinggi daripada reaktan.
Jadi, jika suatu reaksi suhunya dinaikkan, maka akan bergeser ke arah yang menyerap kalor (reaksi endoterm). Sementara itu, jika suhu diturunkan, maka akan bergeser ke arah yang melepaskan kalor (reaksi eksoterm). Simak ilustrasi berikut ini.
CaCO3 (s) CaO (s) + CO2 (g) ΔH = +178 kj/mol
Dalam reaksi tersebut, terdapat entalpi positif artinya reaksi tersebut menyerap kalor dari lingkungannya. Jika suhu ditingkatkan, maka reaksi akan bergeser ke arah kanan (produk). Suhu reaktan akan diperkecil oleh sistem, sehingga reaksi akan cenderung menyerap kalor ke produk.
N2 (g) + 3H2 (g) 2NH3 (g) ΔH = -92 kj/mol
Berbeda dengan reaksi pembuatan kapur dari batu kapur sebelumnya, proses pembentukan amonia memiliki nilai entalpi negatif, yang berarti termasuk reaksi eksoterm. Jika suhu reaksi dinaikkan maka akan bergeser ke arah reaktan, begitu sebaliknya.
Apa Itu Tetapan Kesetimbangan Kimia?
Hukum Waage menyebutkan bahwa: “dalam keadaan setimbang dan suhu tertentu, hasil kali konsentrasi hasil reaksi dibagi dengan hasil kali pereaksi yang terdapat pada reaksi kesetimbangan, kemudian dua-duanya dipangkatkan dengan koefisiennya memiliki harga tetap”.
Hasil bagi tersebut dikenal dengan istilah tetapan kesetimbangan (K).
Tetapan kesetimbangan (K) merupakan konstanta yang menunjukkan perbandingan antara reaktan dan produk secara kuantitatif. Secara umum, persamaan reaksi kesetimbangan dapat dituliskan seperti dengan rumus berikut ini:
pA(g) + qB (g) cC (g) + sD (g)
Saat reaksi kesetimbangan mulai ada suatu aksi, maka kesetimbangan akan bergeser dan mengubah komposisi masing-masing zat untuk mencapai kesetimbangan. Secara umum, inilah rumus untuk menghitung harga kesetimbangan:
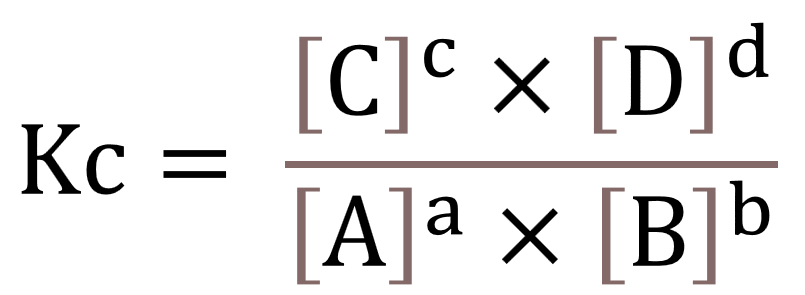
2 Jenis Kelompok Tetapan Kesetimbangan
Tetapan kesetimbangan terbagi menjadi beberapa kelompok berdasarkan acuan yang berbeda.
1. Tetapan Kesetimbangan Berdasarkan Konsentrasi (Kc)
Penentuan nilai kesetimbangan berdasarkan konsentrasi zat (Kc) perlu memperhatikan wujud zatnya. Nilai kesetimbangan konsentrasi (Kc) hanya bisa dihitung dengan wujud zat gas (g) atau larutan (aq). Jika terdapat wujud zat lain, maka diabaikan saja. Untuk lebih jelasnya, cermati beberapa contoh berikut ini.
a. Reaksi Homogen
Dalam satu reaksi menunjukkan adanya kesamaan fase (wujud). Berikut ini contoh reaksi dalam satu fase, yaitu gas (g).
aA (g)+bBcC (g) +dD(g)
Jika terdapat persamaan seperti itu, maka rumus yang digunakan adalah sebagai berikut:
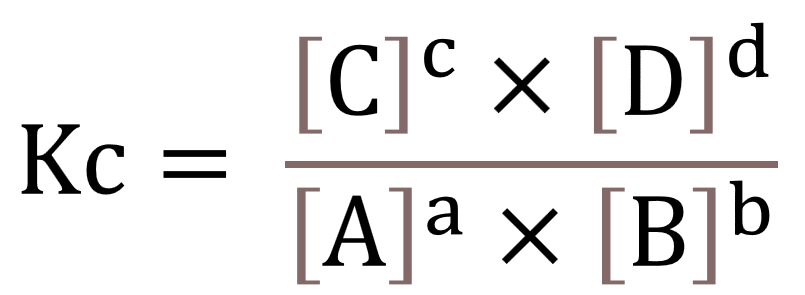
b. Reaksi Heterogen
Pada satu reaksi terdapat fase variasi, artinya zat tersebut tidak hanya berwujud gas, melainkan bermacam-macam. Bagaimana menentukan harga tetapan kesetimbangannya?
Perlu diingat, penentuan tetapan kesetimbangan hanya berlaku untuk konsentrasi zat yang berwujud gas (g) atau larutan (aq). Selain wujud gas, diabaikan, karena wujud larutan (aq) dan liquid (l) tidak memiliki perubahan konsentrasi (tetap).
aA(g)+bB (s)cC (l) +dD(aq)
Lantaran [B] dan [C] wujudnya bukan gas (g) atau larutan (aq), maka dianggap tetap, sehingga rumusnya adalah sebagai berikut.
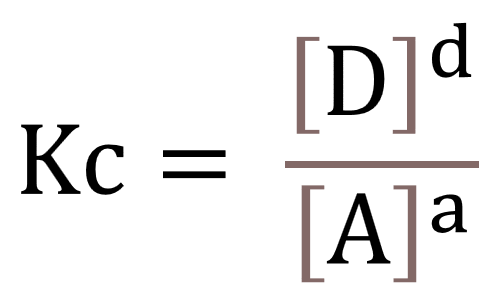
2. Tetapan Kesetimbangan Berdasarkan Tekanan (Kp)
Untuk tetapan kesetimbangan dengan acuan tekanan parsial (Kp), maka yang terlibat adalah tekanan parsial zatnya. Dalam persamaan reaksi, kamu hanya menghitung yang zat yang berwujud gas saja. Jika terdapat fase variatif, maka harga kesetimbangan selain fase gas adalah nol (tetap).
Inilah ilustrasi persamaan reaksi dan rumusnya:
aA (g)+bBcC (g) +dD(g)
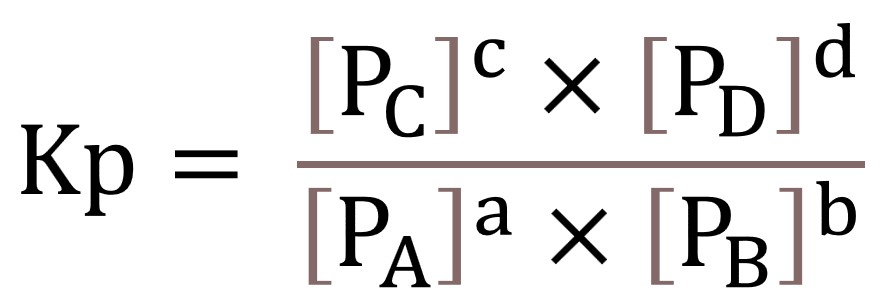
Simak Contoh Soal Kesetimbangan Kimia Berikut, Yuk!
Soal
Terdapat 1 liter campuran gas dengan suhu 100oC. Pada keadaan setimbang zat tersebut mengandung 0.0045 mol dinitrogen tetraoksida dan 0.03 mol nitrogen dioksida. Hitunglah harga tetapan kesetimbangan beserta rumusnya!
Penyelesaian
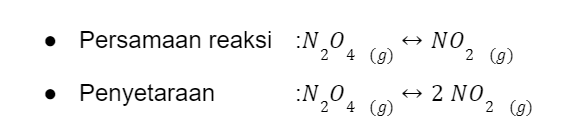
Sesuai dengan teori sebelumnya, rumus tetapan kesetimbangan adalah perbandingan molaritas produk (nitrogen dioksida) dengan molaritas pereaksi (dinitrogen tetraoksida), lalu masing-masing dipangkatkan dengan koefisiennya.

Seberapa Penting Kesetimbangan Kimia Dalam Kehidupan?
Kamu bisa menemukan peristiwa dalam kehidupan sehari-hari yang berkaitan dengan kesetimbangan. Contohnya, pernapasan yang melibatkan hemoglobin dan oksigen.
Ketika manusia berada dalam ketinggian yang memiliki tekanan rendah, maka akan menyebabkan pengikatan oksigen dalam tubuh lebih lambat. Jika sudah terbiasa, secara otomatis hemoglobin dalam tubuh akan memproduksi lebih banyak dari biasanya.Konsep tersebut sesuai dengan hukum kesetimbangan kimia, ketika produksi hemoglobin ditingkatkan maka reaksi akan bergeser ke arah produk, sehingga dapat membantu hemoglobin dalam bereaksi dengan oksigen.