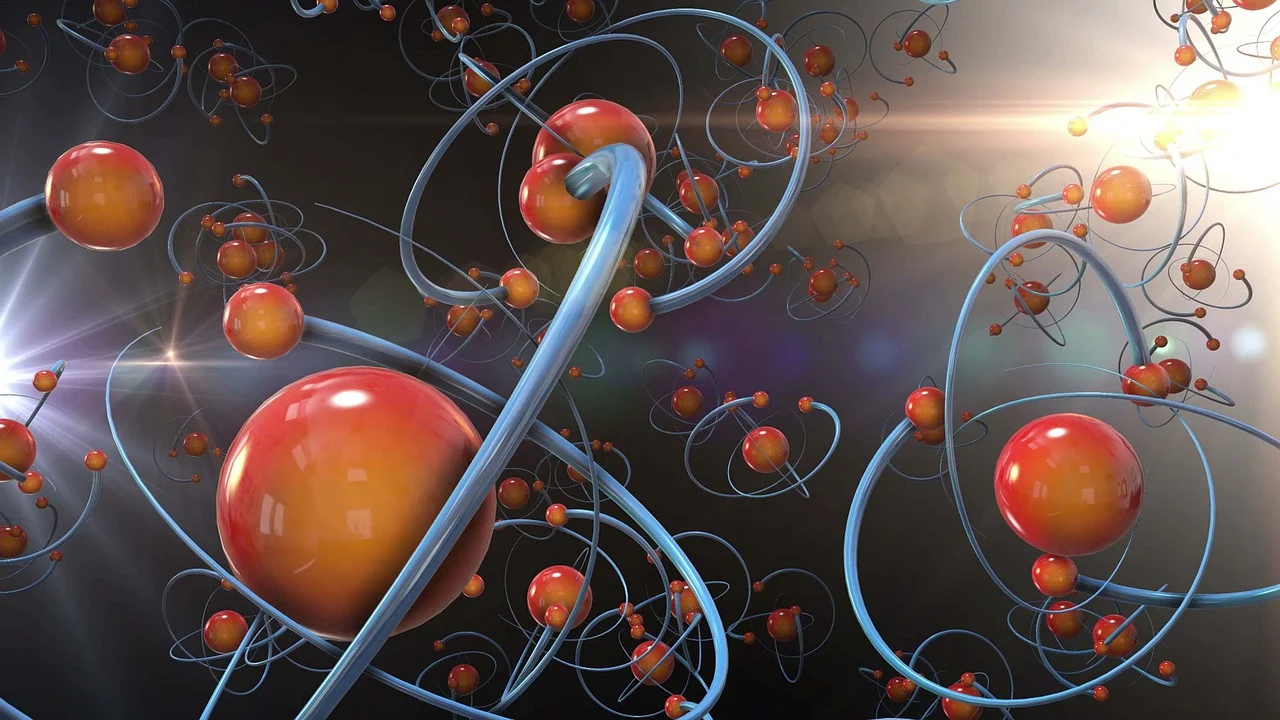
Struktur atom merupakan satuan inti atom yang terdiri atas proton, neutron, dan elektron. Di dalamnya terdapat inti atom yang disebut dengan nukleus. Proton dan neutron berada di dalam nukleus sedangkan elektron bergerak mengelilingi inti. Lalu, bagaimana sebenarnya pembentukan atom ini? Simak, ulasannya berikut ini!
Daftar ISI
Asal Usul Konsep Atom
Konsep atom tercetus pertama kali pada tahun 440 SM oleh Leucippus, dan pada tahun 420 SM oleh Democritos. Atom berasal dari kata ‘atomos’ isilah asal Yunani ini memiliki arti ‘tidak dapat dipecah’ ‘tidak terbagi lagi’.
Mulanya, pemikiran Leucippus dan Democritos menjelaskan suatu partikel yang terdiri dari materi akan bergerak terus menerus di ruang hampa. Materi itu disebut atom, yang senantiasa bergerak dan tidak dapat dipecah lagi.
Namun, konsep tersebut ditolak oleh Aristoteles, seorang ahli filsuf yang kredibilitasnya tinggi dalam pengetahuan di bidang astronomi. Ia mengungkapkan alam semesta terbagi atas air, udara, tanah, dan api serta di sana tidak terdapat ruang hampa.
Perdebatan ahli filsuf tersebut membuat adanya beberapa teori atom berdasarkan modelnya.
1. Teori Atom Dalton
Pada awal abad ke-19, tahun 1803, John Dalton menjelaskan gagasannya terkait teori struktur atom. Model atom dalton berbentuk lingkaran seperti bola pejal, yang bersifat identik dan tidak bermuatan.
Menurutnya suatu atom yang terdiri dari unsur yang sama memiliki sifat yang sama. Tetapi, jika tersusun dari unsur yang berbeda, maka sifatnya juga beda. Dalton, juga mengemukakan atom-atom tidak dapat berubah akibat adanya reaksi kimia.

2. Teori Atom Thomson
Teori kedua ini memiliki tujuan untuk memperbaiki teori atom Dalton. Joseph John Thomson, seorang filsuf asal Amerika, melakukan eksperimennya tentang sinar katoda. Beliau menemukan bahwa sinar katoda tersebut merupakan sebuah partikel.
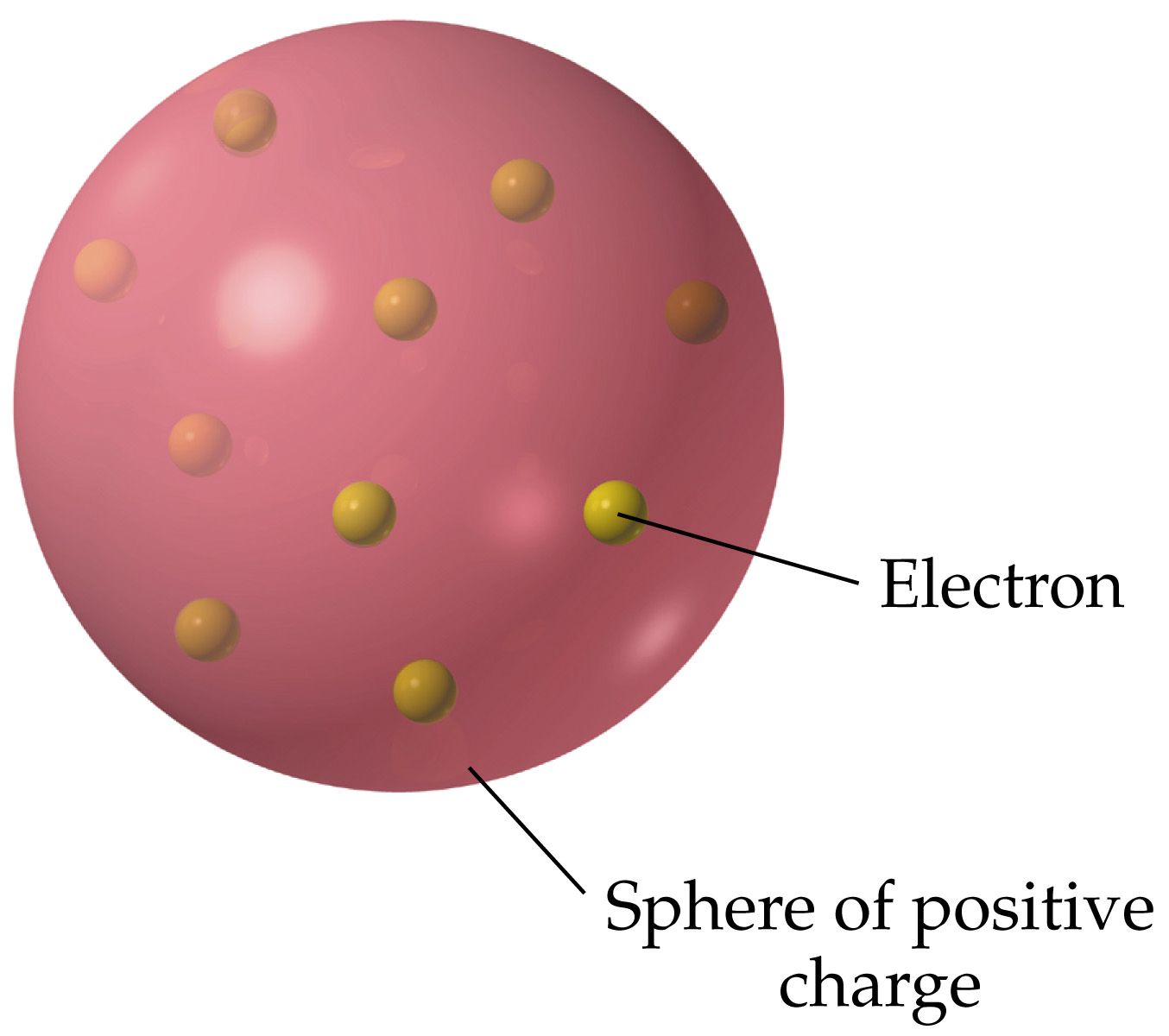
Setelah mengetahui fakta tersebut, Thomson mengemukakan bahwa sinar katoda merupakan partikel bermuatan negatif, yang disebut elektron. Teori ini dikenal seperti teori roti kismis. Jadi, isi teori Thomson adalah bahwa pada sebuah bola atom terdapat muatan positif yang di dalamnya tersebar muatan negatif secara merata.
3. Teori Atom Rutherford
Setelah teori atom Thomson, perkembangan selanjutnya adalah teori struktur atom dari Rutherford. Beliau merupakan ilmuwan fisika yang merupakan murid dari Thomson sehingga ia memperbaiki konsep dari gurunya.
Rutherford melakukan eksperimen penembakan sinar alfa ke lempeng emas yang sangat tipis. Hasilnya, sebagian besar sinar alfa ada yang diteruskan, dibelokkan dan dipantulkan.
Sinar alfa yang dipantulkan mengartikan suatu atom terdiri atas ruang rapat dan padat. Sinar yang dibelokkan mengacu pada sinar alfa yang melewati lempeng bermuatan positif, sehingga arah sinar belok karena terjadi tolakan lempeng yang memiliki muatan sama.
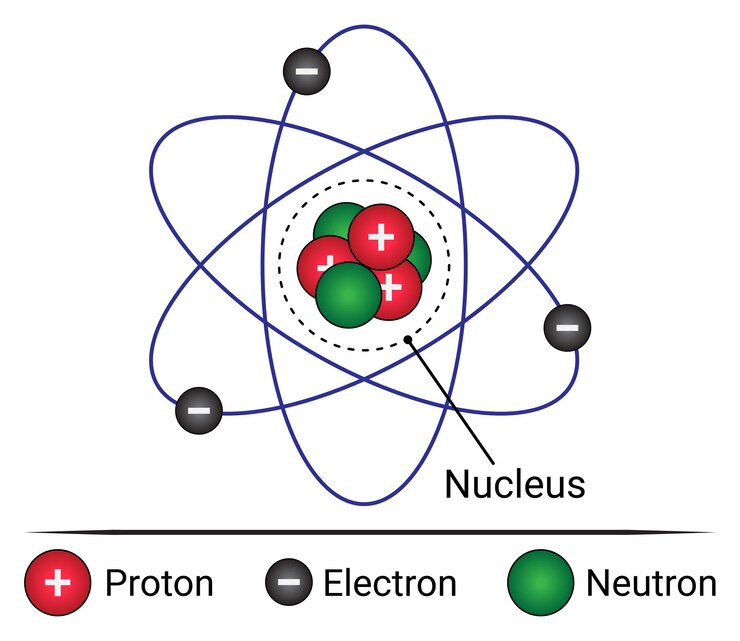
Oleh karena itu, isi teori atom Rutherford adalah suatu atom memiliki inti bermuatan positif dan elektron yang tersebar mengelilingi inti. Inti proton tersebut berada pada pusat atom yang memiliki ukuran lebih kecil daripada atom.
4. Teori Atom Bohr
Selanjutnya, teori atom Niels Bohr mengemukakan temuannya mengenai atom pada tahun 1913 berkaitan dengan teori kuantum. Dalam suatu atom, elektron mengelilingi inti atom dan berpindah dari tingkat energi satu ke energi yang lain. Tingkat energi itu disebut bilangan kuantum atau kulit atom.
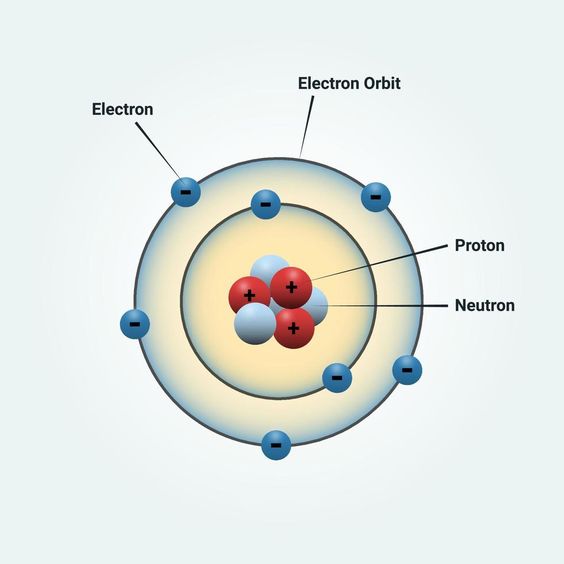
Masing-masing teori di atas memiliki kelebihan dan kelemahannya sendiri. Sejak abad ke-20, teori struktur atom menjelaskan bahwa atom terdiri atas inti atom yang bermuatan positif dan elektron bermuatan negatif mengitari inti.
Apa Saja Sih Partikel Penyusun Struktur Atom Itu?
Partikel penyusun atom dan sifat dasar suatu materi berperan dalam pembentukan atom. Maka dari itu, tiap jenis atom memiliki sifat dan partikel yang sama. Susunannya terdiri atas partikel subatomik dan beberapa komponen penyusun atom. Berikut beberapa komponen partikel tersebut.
1. Partikel Subatomik
- Proton
Proton merupakan suatu inti atom yang bermuatan positif. Muatan ini ditemukan oleh Eugene Goldstein, seorang fisikawan Jerman, melalui percobaan katoda. Muatan proton adalah +1, dengan jumlah massa atom 1.
- Elektron
Joseph John Thomson merupakan pencetus teori atom melalui eksperimen sinar katoda pada tahun 1897. Sementara itu, pada tahun 1909, Robert Millikan juga melakukan eksperimennya dengan percobaan tetesan minyak.
Hasil riset tersebut menunjukkan elektron bermuatan -1, dan massa elektronnya 0.
- Neutron
Percobaan oleh J. Chadwick pada tahun 1932, mengemukakan bahwa partikel yang menciptakan radiasi berdaya tinggi ternyata tidak memiliki muatan. Berdasakran percobaan tersebut, beliau menjelaskan bahwa neutron memiliki muatan nol, dengan massa neutron adalah 1.
2. Kulit Atom
Kulit atom merupakan tempat lintasan elektron untuk mengelilingi inti. Orbit ini memiliki kapasitas tertentu yang bersifat tetap.
- Kulit atom (k) dapat mengisi kulit elektron maksimal berjumlah 2,
- (l) dapat memuat maksimal 4 elektron, sedangkan
- (m) memuat kulit elektron maksimal 8.
Semakin besar bilangan kuantum pada atom, maka semakin jauh jarak kulit atom dari inti, dan semakin besar energi elektron yang beredar.
3. Nomor Atom dan Nomor Massa
Dalam satu atom, terdapat nomor atom dan nomor massa sendiri. Nomor atom adalah jumlah proton yang ada pada nukleus (inti atom). Sedangkan nomor atom merupakan jumlah proton dan neutron dalam inti atom.
Fungsi Struktur Atom Dalam Kimia
Secara teori, komposisi atom ternyata memiliki beberapa fungsi dalam tabel periodik maupun reaksi kimia. Berikut 4 fungsi susunan atom yang patut Anda ketahui.
1. Penentuan Identitas Unsur
Setiap unsur memiliki nomor atom yang berbeda dengan lainnya. Perbedaan itu memudahkan untuk klasifikasi unsur dalam tabel periodik berdasarkan susunan atom.
2. Penentuan Sifat Kimia
Sifat kimia dapat dilihat pada teori konfigurasi elektron. Contohnya, elektron valensi memiliki peran dalam membentuk ikatan kimia.
3. Menentukan Reaktivitas Kimia
Reaktivitas atom dapat ditentukan melalui interaksi elektron pada orbit. Konfigurasi elektron juga menimbulkan adanya kecenderungan atom untuk bereaksi dengan unsur yang lain.
Perbedaan Isotop, Isobar, dan Isoton Dalam Struktur Atom
Dalam komposisi atom, ketiga elemen tersebut memiliki peran dan perbedaan masing-masing. Pelajari penjelasan singkat yang menunjukkan perbedaan ketiganya berikut ini.
1. Nomor Massa Isotop
Isotop merupakan atom atom dalam unsur kimia yang memiliki jumlah proton sama namun nomor massa berbeda. Contohnya suatu atom karbon memiliki jumlah proton 6, namun massa atomnya ada tiga, yaitu 12, 13, dan 14.
2. Nomor Atom Isobar
Isobar merupakan atom-atom yang memiliki nomor atom berbeda namun nomor massanya sama. Contohnya atom hidrogen dan helium, hidrogen memiliki nomor atom 1 dan massa atom 3, sedangkan helium memiliki nomor atom 2 dan massa atom 3.
3. Jumlah Proton pada Isoton
Isoton merupakan atom-atom yang memiliki neutron sama, namun jumlah proton berbeda. Jumlah neutron didapatkan dari selisih nomor massa dengan nomor atomnya. Contohnya atom hidrogen dengan atom helium. Jika nomor atom dan nomor massanya dikurangi, maka hasil keduanya adalah 2.
Muatan Listrik dan Struktur Atom
Suatu atom terdiri atas proton bermuatan positif dan neutron bermuatan netral. Keduanya membentuk suatu inti atom yang disebut nukleus. Elektron yang bermuatan negatif mengelilingi inti menghasilkan gaya elektromagnetik. Sekumpulan atom yang terikat dengan gaya elektromagnetik ini akan membentuk suatu molekul.
Dalam dunia fisika, gaya elektromagnetik disebabkan oleh partikel-partikel yang memiliki muatan listrik. Muatan listrik terjadi apabila dua benda yang sama akan tarik menarik sedangkan dua benda yang berbeda akan tolak menolak.
Teori kimia menyebutkan adanya ion positif dan ion negatif dalam muatan listrik. Proses ionisasi merupakan pergantian suatu atom atau molekul menjadi ion dengan cara melepaskan atau menerima elektron.
Ion positif merupakan suatu atom yang memiliki proton lebih banyak dan akan melepaskan satu/lebih elektron. Sebaliknya, ion negatif memiliki elektron yang lebih banyak sehingga ia akan menerima satu/lebih elektron.
Apa Peran Struktur Atom Dalam Kehidupan Sehari-hari?
Seperti yang telah disinggung sebelumnya, atom merupakan bagian yang paling kecil pada materi-materi yang ada muka bumi. Atom-atom yang bergabung akan membentuk suatu unsur. Sementara gabungan dari suatu unsur disebut dengan molekul.
Manusia dan makhluk hidup juga membutuhkan molekul, seperti air (H2O), Udara (CO2), juga gas (H2), begitu pula dengan berbagai proses di alam semesta, seperti proses metabolisme dan ionisasi.
Semua itu menunjukkan bahwa struktur atom merupakan bagian dari proses kehidupan manusia dan makhluk-makhluk hidup lainnya di Bumi, mulai dari perkembangan, pertumbuhan, hingga kematian.