Dalam bidang ilmu kimia, tidak ada yang lebih berharga daripada tabel periodik unsur kimia. Tabel ini tidak hanya sekedar gambaran elemen-elemen yang membentuk materi di sekitar kita, tetapi juga mewakili landasan ilmiah bagi segala hal, mulai dari reaksi kimia hingga teknologi modern.
Lalu, bagaimana cara membaca elemen-elemen tersebut? Tidak perlu bingung. Artikel ini akan memberikan panduan untuk Anda agar lebih mengenali tentang tabel periodik unsur kimia dan bagaimana cara membacanya.
Apa Itu Tabel Periodik Unsur Kimia?
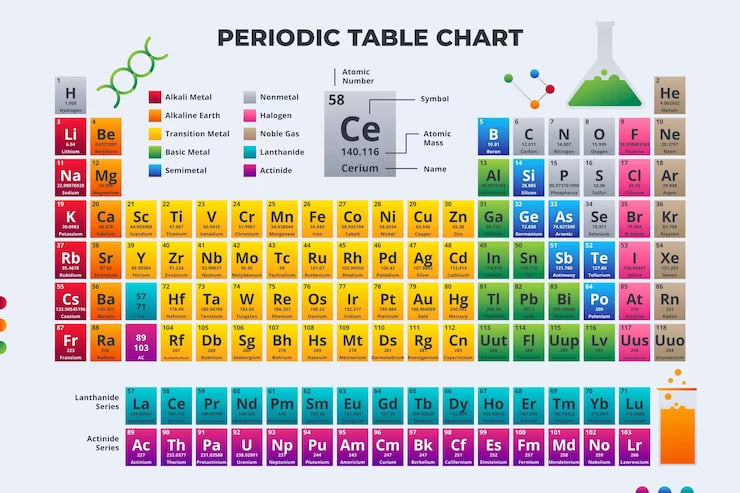
Tabel periodik adalah susunan unsur-unsur yang mengacu pada nomor atom dan sifat kimianya. Unsur-unsur ini tersusun secara rapi dalam baris dan kolom, di mana baris mewakili periode, sedangkan kolom mewakili kelompok.
Kemudian, unsur-unsur letaknya dari kiri ke kanan dan dari atas ke bawah berdasarkan nomor atom yang semakin besar. Unsur-unsur yang berada dalam kelompok yang sama memiliki banyak kesamaan dalam sifat kimianya. Karena unsur-unsur tersebut memiliki jumlah elektron valensi yang sama.
Namun, di sisi lain, unsur-unsur dalam periode yang sama memiliki pola urutan elektron valensi yang berbeda seiring dengan peningkatan nomor atom. Sehingga, saat tingkat energi atom meningkat, jumlah sub-tingkat energi dalam setiap tingkat energi juga bertambah.
Dari 94 unsur pertama dalam tabel periodik unsur kimia, semuanya ditemukan secara alami di alam. Namun, unsur dengan nomor atom dari 95 hingga 118 hanya bisa tercipta dalam laboratorium atau reaktor nuklir.
Tabel periodik modern yang kita gunakan sekarang telah mengalami perkembangan dari model-model awal cetusan ilmuwan pada abad ke-19 dan ke-20. Nah, Dimitri Mendeleev adalah seorang ilmuwan kimia yang paling berjasa dalam konsep ini.
Mendeleev sangatlah terkenal karena menjadi ilmuwan pertama yang mengembangkan tabel periodik yang mana banyak bermanfaat hingga saat ini. Tetapi, ide-ide dari ilmuwan seperti John Newlands dan Antoine-Laurent de Lavoisier juga berkontribusi dalam pengembangan tabel periodik unsur kimia.
Mengapa Tabel Periodik Mendeleev Diterima Secara Luas?
Tabel periodik yang Mendeleev ajukan mendapat respon positif karena memiliki prediksi yang mengesankan. Mendeleev, sebagai pencipta tabel periodik, pada awalnya mengembangkan versi awal tabel periodik yang memiliki kesamaan dengan yang kita kenal sekarang.
Meskipun ada perbedaan penting antara hukum periodik Mendeleev dan hukum modern. Ada alasan kuat mengapa kontribusinya mendapat respon dengan baik.
Perbedaan utama adalah bagaimana Mendeleev mengatur unsur-unsur. Ia mengatur unsur-unsur berdasarkan peningkatan massa atom, sementara hukum modern menggunakan peningkatan nomor atom.
Meski demikian, Mendeleev berhasil membuat prediksi yang mengagumkan tentang unsur-unsur yang belum ditemukan pada saat itu. Pada masa itu, hanya sekitar setengah dari jumlah unsur yang kita kenal sekarang yang telah menemukannya, dan pengetahuan tentang sifat-sifat unsur tersebut juga tidak sepenuhnya akurat.
Tabel periodik unsur kimia Mendeleev pertama kali dipublikasikan pada tahun 1869 dalam German Journal of Chemistry. Meskipun ia mengatur unsur-unsur berdasarkan massa atom, ia mampu meramalkan keberadaan dan sifat-sifat beberapa unsur yang belum ditemukan pada saat itu.
Ini menunjukkan kemampuan luar biasa dalam merumuskan pola-pola yang menghubungkan sifat-sifat kimia unsur-unsur. Bahkan dengan keterbatasan data yang tersedia pada masanya.
Seiring berjalannya waktu dan penemuan lebih lanjut, tabel periodik mengalami perubahan menjadi bentuk yang lebih akurat dan sesuai dengan hukum periodik modern. Namun, kontribusi awal Mendeleev menjadi dasar yang kuat bagi perkembangan selanjutnya dalam memahami dan mengorganisir unsur-unsur kimia.
Mengapa Tabel Periodik Unsur Kimia Perlu Klasifikasi?
Semua materi yang ada di sekitar kita terdiri dari unit-unit dasar yang terkenal sebagai unsur. Pada awalnya, sekitar tahun 1800, hanya 31 unsur kimia yang telah ilmuwan temukan. Namun, perkembangan teknologi pada tahun 1865 membantu mengungkap sekitar 63 unsur baru.
Kondisi ini menciptakan kebutuhan untuk mengklasifikasikan unsur-unsur ini secara berkala. Saat ini, para ilmuwan telah berhasil mengidentifikasi 118 unsur yang berbeda. Beberapa di antaranya bahkan tercipta oleh manusia dalam laboratorium.
Ketika jumlah unsur masih terbatas pada 31, pemahaman terhadap sifat-sifat setiap unsur cenderung lebih mudah. Dengan meningkatnya jumlah unsur menjadi 118, studi terperinci terhadap setiap unsur menjadi jauh lebih kompleks.
Agar dapat mengatasi kompleksitas ini, para ilmuwan mengembangkan metode untuk menyederhanakan penelitian mengenai unsur-unsur. Pendekatannya adalah dengan menyusun unsur-unsur dalam tabel periodik berdasarkan informasi yang tersedia tentang karakteristik-karakteristik unsur-unsur tersebut.
Para ilmuwan menyadari bahwa unsur-unsur menunjukkan pola berulang dalam sifat-sifat kimianya. Dalam upaya ini, berbagai tabel periodik unsur kimia dirancang untuk mengatur unsur-unsur sesuai dengan pola-pola ini.
Tujuannya adalah agar dapat memahami sifat-sifat unsur secara lebih sistematis dan efisien. Tabel periodik membantu mengelompokkan unsur-unsur, mempermudah pemahaman, dan memungkinkan identifikasi unsur-unsur berdasarkan pola yang ada.
Berbagai tabel periodik tercipta untuk menyusun unsur-unsur secara teratur berdasarkan ciri-ciri kimianya, memungkinkan untuk memahami pola-pola tetap dalam sifat-sifat unsur.
Klasifikasi Tabel Periodik Unsur Kimia

Berdasarkan penjelasan di atas, terlihat bahwa tabel periodik unsur kimia adalah tata letak yang mengatur unsur-unsur kimia berdasarkan sifat-sifat kimianya. Klasifikasi dalam tabel periodik ini bergantung pada beberapa karakteristik utama yang mencakup nomor atom, massa atom, dan sifat-sifat kimia.
1. Sifat-sifat Umum
Tabel periodik mengklasifikasikan unsur-unsur berdasarkan sifat-sifat umum mereka menjadi beberapa kelompok atau kategori berikut:
- Unsur-unsur kimia memiliki tiga kategori utama, yaitu logam, metaloid, dan nonlogam.
- Logam adalah padatan mengkilap dengan konduktivitas tinggi yang mana membentuk alloy dan senyawa ion dengan nonlogam.
- Nonlogam adalah gas atau padatan yang mana membentuk senyawa kovalen dengan unsur nonlogam lainnya.
- Metaloid adalah unsur yang berada di antara logam dan nonlogam.
- Logam dan nonlogam dikelompokkan dengan warna yang berbeda pada tabel periodik unsur kimia.
- Logam dan nonlogam tergantung pada jumlah yang lebih dominan dalam unsur kimia.
- Unsur-unsur ini membuatnya jadi kelompok dalam sub kategori seperti alkali, logam transisi, dan lainnya.
2. Keadaan Materi
Kemudian, tabel periodik juga dapat terklasifikasikan berdasarkan keadaan materi atau fase fisik unsur-unsur tersebut. Berikut adalah beberapa klasifikasi berdasarkan keadaan materi dalam tabel periodik:
- Fase materi (cair, padat, gas) pada suhu dan tekanan standar membedakan unsur-unsur.
- Unsur padat memiliki temperatur konvensional dan tekanan atmosfer, beberapa dalam bentuk gas.
3. Titik Lebur dan Titik Didih

Berikut adalah beberapa klasifikasi tabel periodik unsur kimia berdasarkan titik lebur dan titik didih dalam tabel periodik:
- Titik lebur dan titik didih menunjukkan karakteristik unsur dalam derajat Celcius pada tekanan tertentu.
- Logam dan nonlogam memiliki titik lebur dan titik didih yang berbeda.
4. Massa Jenis
Perlu Anda pahami bahwa tabel periodik tidak biasanya terklasifikasikan berdasarkan massa jenis (atau densitas) unsur-unsur tersebut. Meskipun demikian, Anda dapat membuat beberapa pengamatan umum tentang sifat massa jenis unsur-unsur dalam tabel periodik:
- Massa jenis unsur pada standar dari temperatur dan tekanan (STP) menyatakannya dalam gram per sentimeter kubik (g/cm³).
- Gas yang berbentuk cair atau padat memiliki massa jenis yang sama dengan unsur padat.
5. Struktur Kristal
Beberapa unsur-unsur cenderung memiliki struktur kristal tertentu, sedangkan yang lain bisa ada dalam beberapa bentuk alotropik yang berbeda. Berikut ini klasifikasi lengkap tabel periodik unsur kimia:
- Unsur padat memiliki delapan jenis struktur kristal seperti kubik, heksagonal, dan lainnya.
- Beberapa unsur transuranium (unsur kimia yang memiliki nomor atom lebih besar dari 92) memiliki struktur kristal yang belum sepenuhnya memahaminya.
6. Asal Usul di Bumi
Terakhir, berikut adalah beberapa klasifikasi tabel periodik berdasarkan asal usulnya di bumi:
- Ada 94 unsur alami dan 24 unsur sintetis yang tercipta melalui reaksi nuklir buatan.
- Ada 83 unsur stabil atau radioaktif lemah, serta 11 unsur fanal dengan waktu paruh singkat.
- Unsur fanal terdiri dari polonium, radon, radium, aktinium, protactinium, thulium, astatine, promethium, neptunium, francium, dan plutonium.
Cara Membaca Tabel Periodik Unsur Kimia
Tabel periodik biasanya memberikan informasi berikut untuk setiap elemen:
- Nomor atom: Jumlah proton yang dapat Anda temukan dalam inti atom.
- Nama dan Simbol: Setiap kotak berisi nama unsur, seperti “Hidrogen” atau “Oksigen,” serta simbol kimianya, seperti “H” atau “O.”
- Massa atom: Massa total proton, neutron, dan elektron dalam atom tertentu. Kadang-kadang massa atom dapat bervariasi jika ada isotop unsur, sehingga massa atom yang ada pada tabel periodik adalah rata-rata dari bobot yang bervariasi.
Biasanya, apabila Anda menemukan penulisan massa atom pada tabel periodik yang ditulis menggunakan tanda kurung, itu berarti bahwa jumlahnya adalah hanya perkiraan. Unsur-unsur dengan tanda kurung ini sangat tidak stabil atau baru menemukannya
Saat Anda membaca dari kiri ke kanan pada tabel, nomor atom dan massa atom elemen meningkat. Hal yang sama berlaku saat Anda melakukan perjalanan menuruni tabel periodik.
Sudah Paham dengan Konsep Tabel Periodik Unsur Kimia?
Dalam kesimpulannya, tabel periodik unsur kimia adalah alat penting dalam dunia kimia yang membantu menggambarkan dan mengklasifikasikan unsur-unsur berdasarkan sifat-sifat mereka. Memahami struktur dan cara membaca tabel ini adalah langkah penting dalam memahami dasar-dasar kimia.
Tabel periodik adalah salah satu pencapaian besar dalam sejarah ilmu kimia dan tetap menjadi alat yang sangat berharga dalam penelitian dan pengajaran kimia modern. Dari klasifikasi hingga sifat-sifat, tabel periodik terus menjadi fondasi yang tak ternilai dalam ilmu kimia modern.

