Memahami sifat atom adalah perjalanan yang menarik, penuh dengan evolusi teori dan model. Salah satu langkah penting dalam teori atom yaitu pengembangan teori atom mekanika kuantum, sebuah teori revolusioner yang mengubah pemahaman kita tentang perilaku partikel pada tingkat atomik dan subatomik.
Dalam artikel ini, kita akan mempelajari secara mendalam mengenai teori mekanika kuantum dan mengeksplorasi berbagai aspeknya. Mulai dari perkembangan, teori, model atom, dan juga kelebihan serta kelemahannya. Mari simak penjelasannya di bawah ini!
Daftar ISI
- Pengertian Teori Atom Mekanika Kuantum
- Pengembangan Teori Atom Mekanika Kuantum dari Teori Bohr
- 3 Teori Atom Mekanika Kuantum
- Model Atom Mekanika Kuantum
- Bilangan Kuantum
- Bentuk Orbital Atom
- Prinsip-Prinsip Konfigurasi Elektron
- Kelebihan dan Kekurangan Teori Atom Mekanika Kuantum
- Sudah Paham Mengenai Teori Atom Mekanika Kuantum?
Pengertian Teori Atom Mekanika Kuantum
Singkatnya, teori atom mekanika kuantum yang juga dikenal sebagai konsep fisika kuantum atau konsep kuantum merujuk pada perilaku partikel atom dan subatom pada skala terkecil materi dan energi mekanika kuantum.
Berbeda dengan mekanika klasik yang mengatur perilaku benda pada skala makroskopis, mekanika kuantum mengatur perilaku partikel seperti elektron, proton, dan foton. Jadi, teori atom ini menekankan pendekatan ilmiah untuk memahami perilaku partikel pada skala atomik dan subatomik.
Teroi atom ini juga biasa disebut sebagai teori atom modern. Dalam dunia kuantum, partikel seperti elektron dan proton tidak memiliki posisi atau momentum yang pasti seperti dalam mekanika klasik. Justru sebaliknya, partikel atom memiliki sifat gelombang dan peluang keberadaan dalam berbagai posisi dan energi.
Pengembangan Teori Atom Mekanika Kuantum dari Teori Bohr
Pengembangan mekanika kuantum dimulai dari abad ke-20 ketika Niels Bohr memperkenalkan model Bohr dari atom. Dari model Bohr, kita telah melihat bahwa spektra emisi dari unsur-unsur yang berbeda mengandung garis-garis diskrit. Gambar di bawah ini menunjukkan wilayah terlihat dari spektra emisi untuk hidrogen.

Spektrum emisi hidrogen menunjukkan empat panjang gelombang cahaya dalam wilayah terlihat. Fenomena tersebut adalah hasil dari elektron yang berpindah dari tingkat energi yang lebih tinggi ke yang lebih rendah, dan selama proses ini, energi terlepas dalam bentuk cahaya.
Model atom Bohr berhasil menjelaskan spektra emisi yang teramati dalam spektra hidrogen. Jadi, model Bohr menggambarkan elektron dalam orbit tertentu di sekitar inti atom, yang memungkinkan pemahaman tentang tingkat energi dan perilaku elektron dalam atom hidrogen dan ion helium.
Meski begitu, terlepas dari kesuksesannya dalam meramalkan tingkat energi dalam atom dengan satu elektron, model Bohr tidak mampu menjelaskan struktur elektron dalam atom yang memiliki lebih dari satu elektron.
Kemudian ilmuwan mulai menyadari bahwa model Bohr memerlukan penyempurnaan atau bahkan model yang sepenuhnya baru untuk menjelaskan atom-atom yang lebih kompleks.
3 Teori Atom Mekanika Kuantum
Berikut adalah penjelasan teori atom mekanika kuantum menurut 3 ilmuan besar:
1. Mekanika Kuantum de Broglie
Louis de Broglie mengusulkan bahwa partikel, termasuk elektron, menunjukkan perilaku seperti gelombang sekaligus partikel. Konsep tersebut kemudian dikenal dengan dualitas gelombang-partikel. Dualitas gelombang-partikel ini membentuk dasar konsep bahwa partikel juga memiliki panjang gelombang.
Panjang gelombang de Broglie berbanding terbalik dengan momentum, sehingga partikel dengan momentum lebih tinggi memiliki panjang gelombang lebih pendek dan sebaliknya. Dari sinilah pada akhirnya teori de Broglie membantu menjelaskan fenomena interferensi elektron dan perilaku partikel pada skala kuantum.
2. Mekanika Kuantum Werner Heisenberg
Selain itu, terdapat teori atom mekanika kuantum Heisenberg tentang ketidakpastian. Prinsip ketidakpastian Heisenberg menyatakan bahwa kita tidak bisa secara tepat mengetahui posisi dan momentum partikel pada saat bersamaan.
3. Mekanika Kuantum Erwin Schrödinger
Sementara Erwin Schrödinger mengembangkan persamaan gelombang Schrödinger. Persamaan ini menggambarkan perilaku partikel sebagai fungsi gelombang yang berkembang seiring waktu. Melalui Persamaan Schrödinger, kita dapat memprediksi peluang keberadaan partikel dalam berbagai posisi dan energi.
Model Atom Mekanika Kuantum
Menurut model atom mekanika kuantum, elektron dalam atom dijelaskan sebagai fungsi gelombang yang menggambarkan peluang keberadaannya dalam berbagai posisi dan energi.
Teori atom mekanika kuantum mengusulkan bahwa orbit elektron menurut model Bohr tidak dapat didefinisikan dengan tepat dalam model kuantum. Sebagai gantinya, kita memiliki orbital elektron yang merepresentasikan wilayah tempat elektron mungkin ditemukan dengan probabilitas tertentu.
Bilangan Kuantum
Bilangan kuantum adalah parameter yang beguna untuk menggambarkan keadaan kuantum suatu elektron dalam sebuah atom. Ada empat jenis bilangan kuantum yang dikenal, yaitu utama (n), azimut (l), magnetik (m), dan spin (s). Berikut ini penjelasannya:
1. Bilangan Kuantum Utama (n)
Bilangan kuantum utama menunjukkan tingkat energi atau orbit utama di mana elektron berada. Semakin besar nilai n, semakin tinggi energi elektron dan semakin jauh dari inti atom.
2. Azimut (l)
Sementara bilangan kuantum azimut menunjukkan bentuk orbital atau subkulit tempat elektron berada. Nilai l berkisar dari 0 hingga n-1. Misalnya, jika n = 3, maka nilai l dapat 0, 1, atau 2, yang masing-masing mewakili orbital s, p, atau d. Mengenai orbotal akan kami bahas pada bagian selanjutnya.
3. Magnetik (m)
Selain itu, terdapat teori bilangan atom mekanika kuantum magnetik yang menunjukkan orientasi dalam tiga dimensi ruang orbital di dalam suatu subkulit. Nilai m berkisar dari -1 hingga +1. Ini menggambarkan jumlah kemungkinan arah orbital dalam ruang.
4. Spin (s)
Terakhir, bilangan kuantum spin menunjukkan arah putaran intrinsik elektron. Nilai s adalah +1/2 atau -1/2. Selain itu, spin memiliki dampak penting pada sifat magnetik dan reaktivitas kimia elektron.
Bentuk Orbital Atom
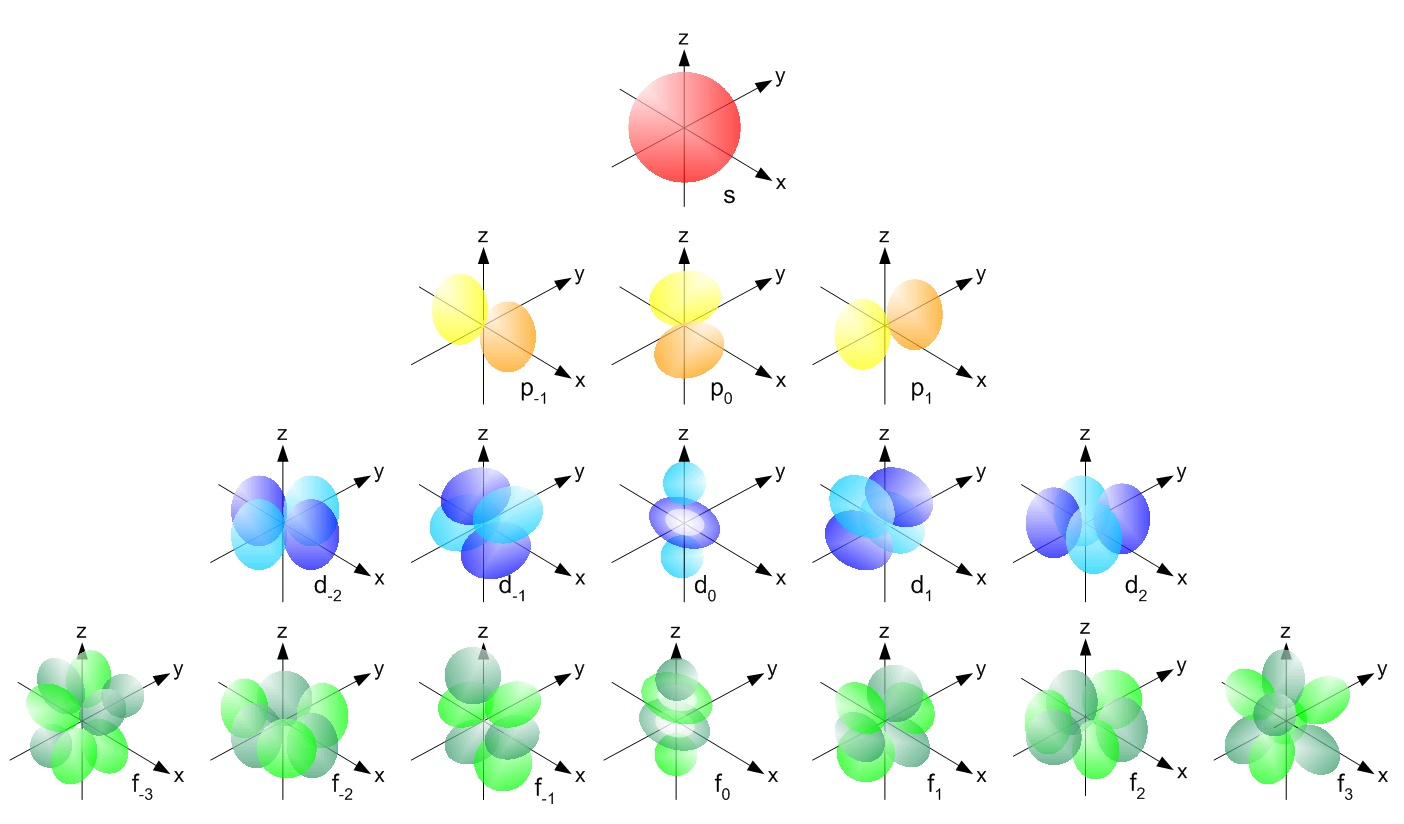
Sementara itu, bentuk orbital atom menggambarkan probabilitas menemukan elektron pada posisi tertentu dalam wilayah ruang tertentu di sekitar inti atom. Orbital atom dibedakan oleh bilangan kuantum azimutnya (l) dan menentukan bentuk dan arah orbital dalam subkulit tertentu, yaitu:
1. Orbital s
Daerah orbital s memiliki bentuk sferis dan memiliki nilai azimut (l) = 0. Pada level energi yang sama, orbital s memiliki ukuran paling kecil dan paling mendekati inti.
2. Orbital p
Sedangkan orbital p memiliki bentuk dumbel dengan tiga orientasi, yaitu px, py, dan pz. Lalu, masing-masing orientasi memiliki nilai azimut (l) = 1.
3. Orbital d
Kemudian terdapat orbital d yang memiliki bentuk yang lebih kompleks dan lebih banyak orientasi daripada orbital s dan p di mana terdapat lima orientasi dengan nilai azimut (l) = 2.
Prinsip-Prinsip Konfigurasi Elektron
Melalui konfigurasi elektron, kita bisa mengetahui perkiraan susunan dan penempatan elektron dalam atom sesuai dengan prinsip-prinsip teori atom mekanika kuantum. Konfigurasi ini ditentukan oleh urutan pengisian orbital dengan mematuhi prinsip berikut:
- Prinsip Aufbau: Menyatakan bahwa elektron akan mengisi orbital dengan energi terendah terlebih dahulu sebelum mengisi orbital dengan energi lebih tinggi.
- Prinsip Pauli: Menyatakan bahwa dalam satu orbital, elektron harus memiliki spin berlawanan (up dan down) dan tidak boleh ada dua elektron dengan semua bilangan kuantum yang sama dalam suatu atom.
- Kaidah Hund: menyatakan bahwa dalam subkulit yang sama, elektron akan mengisi orbital dengan satu elektron terlebih dahulu sebelum mulai mengisi orbital kedua.
Kelebihan dan Kekurangan Teori Atom Mekanika Kuantum
Teori atom mekanika kuantum memiliki lebih banyak kelebihan daripada teori-teori atom klasik sebelumnya, yaitu kemampuannya untuk menjelaskan spektra unsur secara tepat. Sehingga, teori atom modern ini dapat memberikan pandangan yang lebih akurat tentang perilaku partikel pada skala atomik.
Lalu pada penerapannya dapat memberikan dasar bagi teknologi modern seperti elektronika dan fisika nuklir. Namun, tetap terdapat kekurangan, yakni teori atom mekanika kuantum dianggap lebih rumit dan sulit dipahami oleh orang awam. Selain itu juga memerlukan pendekatan matematis yang kompleks dalam penjelasannya.
Sudah Paham Mengenai Teori Atom Mekanika Kuantum?
Jadi, teori atom mekanika kuantum memberikan dasar bagi pemahaman tentang perilaku atom dan partikel-elementer lainnya. Meskipun cukup kompleks, model-modelnya hingga konfigurasi elektron dalam mekanika kuantum berperan penting dalam pemahaman sifat dasar materi.
Jika Anda seorang pelajar yang sedang mempelajari materi ini, pastikan Anda memahami konfigurasi elektron sehingga membantu memahami distribusi energi dan sifat kimia atom. Selain itu, dari konfigurasi elektron-lah Anda dapat meramalkan bagaimana elektron mengisi dan berinteraksi dalam atom berbagai unsur kimia.