Ketika mempelajari atom, terdapat salah satu konsep penting dalam struktur atom, yaitu bilangan kuantum azimut (l). Selain itu, juga terdapat orbital, yaitu wilayah di sekeliling inti atom sebagai tempat di mana elektron berada. Nah, bentuk orbital ditentukan oleh bilangan kuantum terutama kuantum azimut.
Penasaran bagaimana bentuk orbital ditentukan oleh bilangan kuantum? Anda bisa menemukan jawabannya dengan menyimak artikel ini, karena kita akan menjelaskan secara rinci tentang konsep bilangan kuantum azimut, pengaruhnya terhadap bentuk orbital, serta implikasinya dalam konfigurasi elektron.
Daftar ISI
- Konsep Bilangan Kuantum Azimut
- Apa Itu Orbital?
- Bentuk Orbital Ditentukan oleh Bilangan Kuantum
- Jumlah dan Bentuk Orbital Menurut Bilangan Kuantum Azimut
- Prinsip-Prinsip dalam Konfigurasi Elektron
- Contoh Penentuan Konfigurasi Elektron
- Langkah-Langkah Menentukan Bentuk Orbital yang Ditentukan Oleh Bilangan Kuantum
- Sudah Paham Bagaimana Bentuk Orbital Ditentukan Oleh Bilangan Kuantum?
Konsep Bilangan Kuantum Azimut
Bilangan kuantum azimut adalah satu dari empat bilangan kuantum yang menggambarkan keadaan kuantum suatu elektron dalam atom. Secara spesifik, kuantum azimut mengindikasikan bentuk dan orientasi orbital tempat elektron berada di sekitar inti atom.
Nilai bilangan kuantum azimut berkisar dari 0 hingga (n-1), di mana n adalah bilangan kuantum utama yang menunjukkan tingkat energi atau kulit elektron. Dengan kata lain, bilangan kuantum azimut menentukan jumlah subkulit yang ada dalam kulit tertentu.
Apa Itu Orbital?
Sementara orbital merupakan wilayah di sekitar inti atom di mana Anda memiliki probabilitas tinggi untuk menemukan elektron. Melalui konsep ini, Anda dapat memahami sifat gelombang elektron, di mana Anda tidak dapat mengidentifikasi elektron dengan pasti ada dalam posisi tertentu.
Namun, sebenarnya Anda hanya menentukan probabilitas keberadaan elektron di sekitar inti atom. Setiap orbital memiliki tiga angka kuantum utama yang menggambarkan bentuk, ukuran, dan orientasi orbitnya.
Bilangan kuantum utama mengidentifikasi kulit energi di mana letak orbital. Sedangkan bentuk orbital ditentukan oleh bilangan kuantum azimut. Sementara kuantum magnetik menggambarkan orientasi arau arah orbital.
Bentuk Orbital Ditentukan oleh Bilangan Kuantum
Jika Anda sudah mempelajari teori atom kuantum mekanika, maka Anda sudah mempelajari bilangan kuantum, salah satunya yaitu kuantum azimut (l). Namun, apa fungsinya?
Salah satu peran utama bilangan kuantum azimut (l) adalah menentukan bentuk orbital. Masing-masing nilai l memiliki korelasi dengan bentuk orbital yang spesifik. Sementara bentuk orbital menggambarkan tiga dimensi spasial di sekitar inti atom di mana Anda memiliki peluang yang tinggi untuk menemukan elektron.
Jumlah dan Bentuk Orbital Menurut Bilangan Kuantum Azimut
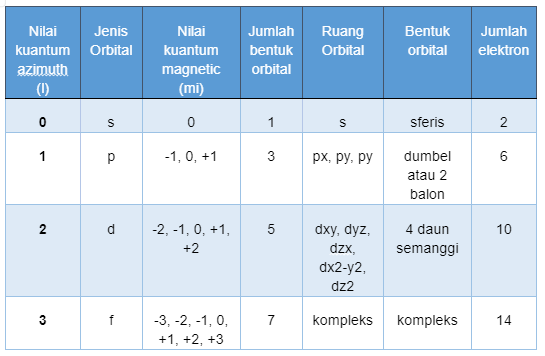
Seperti yang telah kami tegaskan sebelumnya bahwa bentuk orbital ditentukan oleh bilangan kuantum azimut (l) juga menunjukkan jumlah subkulit yang ada dalam suatu kulit tertentu. Kemudian, ada empat bentuk orbital yang berbeda, masing-masing memiliki karakteristik bentuk yang khas:
1. Bentuk Orbital s = 1 Orbital yang Ditentukan Oleh Bilangan Kuantum
Ketika bilangan kuantum azimut (l) sama dengan 0, maka bentuk orbitalnya adalah orbital sferis atau bulat. Artinya, probabilitas tinggi untuk menemukan elektron di sekitar inti atom, dengan kepadatan paling tinggi ada di pusat.
Pertama yaitu orbital 1s dengan kepadatan paling tinggi di pusat, kemudian semakin menurun seiring jaraknya menjauh dari inti atom. Sementara orbital 2s memiliki dua daerah dengan densitas elektron yang tinggi, dan seterusnya.
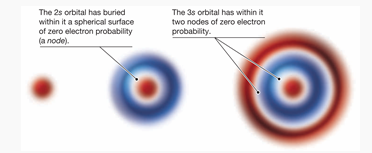
Selain itu, dalam model 3D, penggambaran orbital s seringkali adalah sebagai gelembung yang merata.
2. Bentuk Orbital p = 3 Orbital yang Ditentukan Oleh Bilangan Kuantum
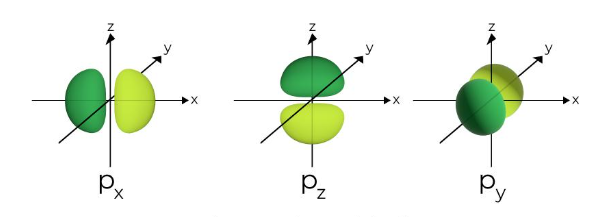
Sedangkan jika bilangan kuantum azimut (l) sama dengan 1, maka orbital atom tersebut adalah orbital p. Bentuknya seperti dumbel atau dua balon dengan dua lobus.
Sementara itu, ada tiga orbital p yang masing-masing mengarah ke sumbu x, y, dan z, atau px, py, dan pz. Walaupun begitu, berbeda dengan orbital s, probabilitas tinggi untuk menemukan elektron justru letaknya di wilayah yang lebih jauh dari inti,.
3. Orbital d = 5 Orbital
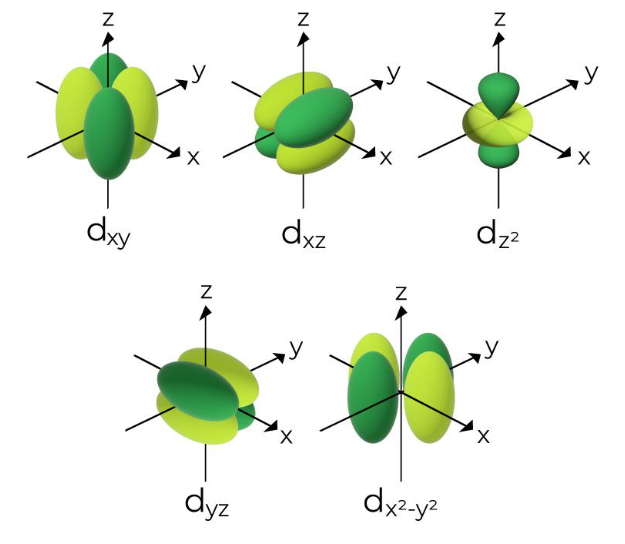
Kemudian, bentuk orbital yang ditentukan oleh bilangan kuantum azimut (l) sama dengan 2 adalah bentuk yang lebih kompleks. Orbital yang lebih kompleks tersebut adalah orbital d yang mana memiliki lima bentuk berbeda, yaitu dxy, dyz, dzx, dx2-y2, dan dz2.
Selain bentuknya yang kompleks, arah elektronnya juga lebih kompleks. Sehingga, peluang untuk menemukan elektron ada di berbagai wilayahnya relatif tinggi.
4. Orbital f = 7 Orbital
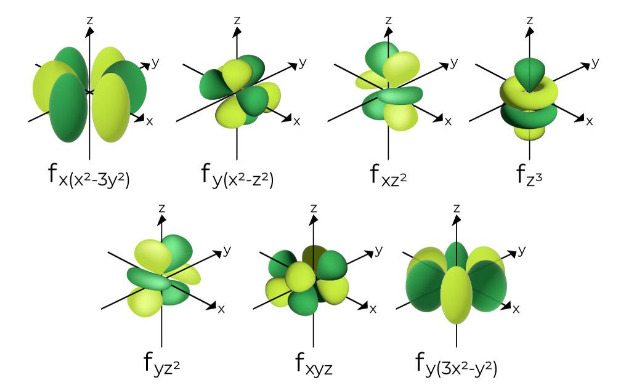
Sementara itu, bentuk orbital f ditentukan oleh bilangan kuantum azimut (l) sama dengan 3. Orbital f memiliki tujuh bentuk dengan lobus dan bentuk yang sangat kompleks.
Bentuk orbital f sangat rumit dan mungkin akan jarang Anda jumpai dalam atom alamiah. Sebab, atom dengan orbital f adalah atom dengan elektron yang sangat banyak. Artinya, elektron tersebut memiliki energi yang sangat tinggi.
Sebagai ringkasan, Anda bisa menyimak tabel di bawah ini untuk memahami bagaimana bentuk orbital ditentukan oleh bilangan kuantum azimut:
Prinsip-Prinsip dalam Konfigurasi Elektron
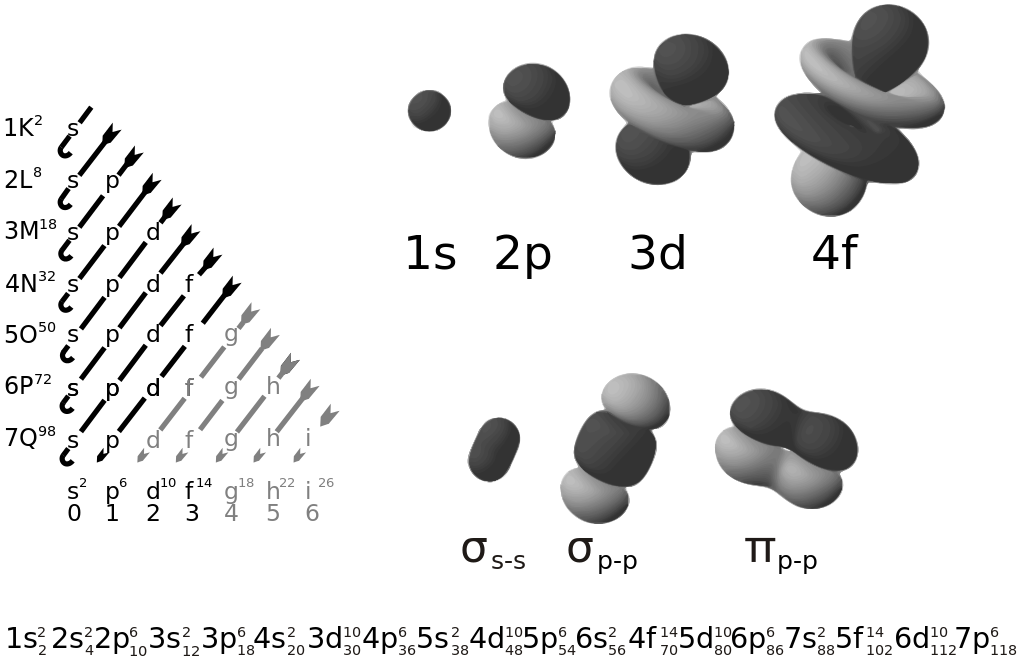
Untuk mengetahui bentuk orbital ditentukan oleh bilangan kuantum azimut, Anda perlu mencari nilai kuantum azimut dengan menggunakan konfigurasi elektron. Maka dari itu, mari kita bahas apa saja prinsip-prinsip dalam menentukan konfigurasi elektron:
1. Prinsip Aufbau
Pertama, menurut prinsip Aufbau, elektron akan mengisi orbital-orbital dengan energi paling rendah dahulu sebelum mengisi orbital-orbital dengan energi yang lebih tinggi. Dengan kata lain, elektron akan mengisi orbital-orbital dalam urutan yang mengikuti urutan peningkatan energi.
Jika Anda menggambar susunan elektron atom, maka Anda harus mengikuti aturan urutan energi orbital. Sebagai contoh, orbital-orbital dengan energi paling rendah adalah orbital 1s, kemudian 2s, 2p, 3s, 3p, dan seterusnya.
2. Prinsip Pauli
Selanjutnya, Prinsip Pauli menyatakan bahwa dalam suatu orbital, setidaknya ada dua elektron yang memiliki spin arah berlawanan (spin atas dan spin bawah). Dengan kata lain, dua elektron dalam satu orbital harus memiliki arah spin yang berbeda.
3. Prinsip Hund
Sementara prinsip Hund menyatakan bahwa dalam subkulit (nilai kuantum azimut) yang sama, elektron akan lebih cenderung mengisi orbital-orbital tunggal dengan arah spin yang sama.
Elektron tidak akan membentuk pasangan elektron terlebih dahulu di orbital yang sama. Sehingga, jika ada tiga orbital p dalam subkulit yang sama, maka satu elektron akan mengisi setiap orbital sebelum mulai membentuk pasangan.
Contoh Penentuan Konfigurasi Elektron
Berikut adalah beberapa contoh menentukan konfigurasi elektron untuk beberapa unsur:
1. Karbondioksida (C)
Pertama, karbon memiliki nomor atom 6. Konfigurasi elektronnya adalah 1s² 2s² 2p². Artinya, dua elektron mengisi orbital 1s, dua elektron mengisi orbital 2s, lalu dua elektron sisanya mengisi orbital 2p.
2. Natrium (Na)
Sementara natrium memiliki nomor atom 11. Maka konfigurasi elektronnya adalah 1s² 2s² 2p⁶ 3s¹. Dalam hal ini, dua elektron mengisi orbital 1s, total delapan elektron mengisi orbital 2s dan 2p pada kulit kedua, dan satu elektron mengisi orbital 3s.
Langkah-Langkah Menentukan Bentuk Orbital yang Ditentukan Oleh Bilangan Kuantum
Penentuan bentuk orbital melibatkan pemahaman tentang subkulit dan jenis orbital yang terlibat. Maka dari itu, bentuk orbital ditentukan oleh bilangan azimut yang menjadi penentu subkulit. Berikut adalah langkah-langkahnya:
- Pertama, identifikasi konfigurasi elektron unsur yang ingin Anda pelajari. Misalnya, konfigurasi elektron untuk karbon adalah 1s² 2s² 2p².
- Kemudian, pahami subkulit yang terlibat di mana setiap subkulit dalam konfigurasi elektron memiliki jumlah orbital yang berbeda.
- Lalu jumlahkan jumlah elektron dalam setiap subkulit untuk menentukan berapa banyak orbital yang terisi. Sebagai contoh, konfigurasi elektron karbon (1s² 2s² 2p²) memiliki total 6 elektron yang berada di dalam 2 kulit. Pada kulit kedua, elektron mengisi satu orbital 2s yang terisi dan tiga orbital 2p.
- Setelah menentukan bentuk orbital, identifikasi subkulit dan nomor orbital dari orbital-orbital yang terisi. Pada contoh karbon, orbital 2s dan orbital-orbital 2p memiliki nomor orbital yang berbeda (2px, 2py, dan 2pz).
- Berdasarkan jumlah orbital yang terisi, tentukan bentuk orbital yang terlibat. Anda bisa melihat gambar dan tabel bentuknya seperti pada bagian sebelumnya dari artikel ini.
Baca Juga: 4 Jenis Bilangan Kuantum, Pengertian, Cara Mencarinya, & Contoh Soal
Sudah Paham Bagaimana Bentuk Orbital Ditentukan Oleh Bilangan Kuantum?
Dalam kesimpulannya, bentuk orbital atom seperti sferis, dumbel atau bentuk kompleks ditentukan oleh bilangan kuantum azimut (l). Namun sebelumnya, mula-mula Anda perlu mengetahui konfigurasi elektron atomnya.
Maka dari itu, pahamilah prinsip Aufbau, prinsip Pauli, dan aturan Hund. Selain itu, untuk pemahaman yang lebih baik, jangan lupa berlatihlah untuk menentukan bilangan kuantum azimut dan konfigurasi elektron berbagai atom.
Dengan begitu, pemahaman Anda tentang bagaimana bentuk orbital terpengaruh bilangan kuantum azimutnya akan semakin kuat. Semoga artikel ini bermanfaat, ya!