Apakah kamu tahu mengenai bilangan kuantum? Mungkin kamu pernah mendengar istilah tersebut saat mata pelajaran IPA khususnya kimia. Bilangan ini erat kaitannya dengan atom, unsur, proton, elektron dan neutron.
Artikel ini akan menjelaskan bilangan tersebut secara lebih lengkap mulai dari jenis-jenisnya, cara mencarinya, hingga contoh soalnya.Yuk, baca sampai selesai agar pemahamanmu semakin bertambah!
Daftar ISI
Apa itu Bilangan Kuantum?

Penggambaran mengenai bilangan kuantum atau quantum number dapat kamu analogikan seperti planet-planet yang mengitari matahari. Kemudian, sang surya merupakan inti atom yang terdapat proton dan neutron di dalamnya. Sementara itu, elektron adalah planet yang mengelilingi matahari sebagai inti tata surya.
Nah, quantum number merupakan lintasan yang terletak di bagian dalam atom yang sedang menjadi tempat pergerakan dari elektron. Atom dikelilingi oleh elektron yang tersebar secara teratur dalam sebuah lintasan orbital.
Sedangkan, melansir laman Wikipedia mengatakan bahwa quantum number adalah bilangan yang menggambarkan kedudukan dari sebuah elektron dalam sebuah model atom mekanika. Sehingga, model ini merupakan model atom yang dipercaya dapat menjelaskan sifat sifat dari sebuah atom.
Setelah kamu mengerti maksud dari bilangan kuantum, kamu harus tahu beberapa jenis dari kuantum. Jadi stay tune terus bacaan ini ya !
Jenis-Jenis Bilangan Kuantum dan Cara Mencarinya
Bilangan kuantum dari sebuah atom terdiri dari beberapa jenis kuantum yang wajib kamu hafal loh. Berikut adalah 4 jenis quantum number beserta cara mencarinya, yaitu:
1. Main Quantum (n)
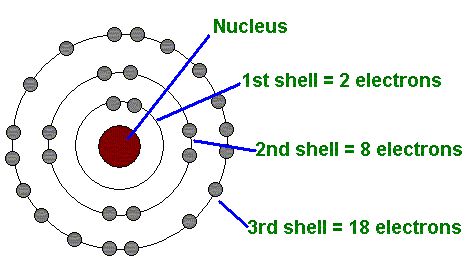
Main quantum adalah kuantum yang menyatakan kulit elektron dan tingkat energinya bergantung pada jarak elektron dengan inti atom. Bilangan ini memiliki simbol huruf (n).
Parameter n merupakan bilangan bulat positif yang dimulai dari angka 1, 2,3, …dan seterusnya atau dapat ditulis n= 1,2,3,…, dan seterusnya.
Apakah kamu ingat mengenai “Model Atom Bohr”? Ya, model ini yang mencetuskan kuantum utama pada tahun 1913 menggunakan atom hidrogen sebagai percobaannya. Selanjutnya, ilmuwan Niels Bohr mengatakan bahwa sebuah atom berisi muatan positif dan dikelilingi dengan muatan negatif.
Kuantum utama mempunyai subkulit K,L,M,N, dst. Apabila nilai n=1, maka termasuk ke dalam kulit K. Nah, huruf K melambangkan kulit pertama dengan n=1.
Begitu juga kulit lainnya, L merupakan lambang untuk kulit kedua dengan n=2. Ya, nilai ini harus positif dan tidak mungkin bernilai negatif atau sama dengan nol.
Kamu bisa menyimpulkan bahwa bilangan ini berfungsi menunjukkan jarak terjauh antara inti atom dengan elektron. Apabila nilai n semakin besar, maka ukuran dan energi orbitalnya juga semakin besar.
2. Azimuth Quantum (l)
Pengertian dari azimuth Quantum adalah bilangan dari sebuah atom orbital yang dapat menentukan momentum sudut orbital. Kuantum ini menjelaskan bentuk dari orbital itu sendiri.
Azimuth dilambangkan dengan huruf (ℓ) dan dapat kamu tulis menggunakan bilangan bulat (ℓ) = 0,1,2,3,…, dan seterusnya. Perlu kamu tahu, dalam setiap orbital terdiri dari nilai (ℓ) yang berbeda-beda yang disebut dengan sub kelopak.
| Bilangan Azimuth (ℓ) | Huruf Historis | Jumlah elektron maksimum |
| 0 | s | 2 |
| 1 | p | 6 |
| 2 | d | 10 |
| 3 | f | 14 |
| 4 | g | 18 |
Jadi, begini rumus mengenai jumlah elektron maksimum = 2 x (2ℓ +1). Sebagai contoh, misalkan yang diketahui hanya n=2 dan yang ditanya adalah jumlah elektron maksimum.
Kamu dapat menjawab n=2=1S, 1P yang artinya jumlah elektron maksimum = 2 x (2ℓ +1) = 2 x (2 (2) +1) = 2 x 3 = 6.
Dari contoh soal di atas, maka dapat diketahui bahwa jumlah elektron maksimum sebanyak 6.
Baca Juga: Bagaimana Bentuk Orbital Ditentukan Oleh Bilangan Kuantum Azimut?
3. Magnetic Quantum
Dalam fisika atom, magnetic quantum adalah bilangan yang menyatakan orbital dari sebuah elektron dalam ruang tiga dimensi. Jika, kulit kuantum merupakan kamarnya lalu subkulit adalah lantainya.
Nah, magnetic quantum (ml) adalah distribusi elektron dari kamar ke lantai. Kuantum yang satu ini sangat bergantung pada azimuth quantum.
Misalnya, suatu elektron memiliki bilangan azimuth (ℓ) =3 dan berada pada orbital d. Nilai dari magnetic quantum (ml) adalah m= -3, -2, -1, 0, 1, 2,3.
4. Spin Quantum
Spin Quantum adalah kuantum yang memberikan arah putaran elektron. Bilangan ini mempunyai notasi huruf (s) dan memiliki lambang +1/2 (spin up) dan -1/2 (spin down).
Kuantum ini bergantung pada dirinya sendiri tanpa bantuan Kuantum lainnya (utama, azimuth, dan magnetik). Selain itu, kuantum ini berfungsi menunjukkan orientasi momentum sudut intrinsik elektron suatu atom.
Dalam spin quantum, elektron memiliki arah putaran ke atas apabila nilainya positif dan berputar ke bawah apabila nilainya negatif.
6 Contoh Soal Bilangan Kuantum
Nah, berikut ini adalah 6 contoh soal-soal untuk cara menentukan bilangan kuantum, yaitu:
Soal ke 1
Azimuth Quantum dapat menunjukkan….
A. Kulit atom
B. Bentuk orbital
C. Orientasi/arah
D. Rotasi elektron
E. Bentuk lintasan
Soal ke 2
Bilangan kuantum mana yang tepat untuk memungkinkan elektron dalam orbital 3p3 adalah …
A. n=1, l=2, m=0, s=+½
B. n=1, l=0, m=0, s=+½
C. n=0, l=1, m=0, s=-½
D. n=2, l=1, m=1, s=-½
E. n=3, l=1, m=1, s=+½
Pembahasan:
Dari soal di atas, diketahui bahwa elektron tersebut berada pada kulit pertama maka n = 3. Setelah itu, mencari azimuth quantum pada kulit ketiga.
Nah, pada orbital 3p hanya terdapat 1 subkulit s sehingga (l = 1). Sedangkan pada nilai l adalah 1, sehingga m=1. Setiap orbital maksimum berisi 2 elektron, namun pada 3p3 berisi 3 arah ke atas dengan arah spin (s = +1/2 ).
Soal ke 3
Azimuth quantum (l) yang masih dimungkinkan untuk l = 2 adalah . . . .
A. 1, 2, 4
B. 0, 1, 2
C. 1, 2, 3, 4,
D. 1, 2, 4, 6
Pembahasan :
Jika n = 3, maka nilai l = 0, …..(n-1) = 0, 1, 2
Soal ke 4
Bilangan kuantum magnetik (m) = +1 dimiliki oleh elektron dari atom yang memiliki kulit elektron minimal sebanyak. . . .
A. 2
B. 3
C. 4
D. 5
Pembahasan:
Diketahui m = +1, artinya nilai dari azimut kuantum elektron minimal adalah 1. Nah, karena nilai magnetic quantum bergantung pada azimuth quantum pada harga l =1, maka harga m- nya adalah (-1, 0, +1).
Sehingga untuk l=1 minimal suatu atom harus memiliki main quantum sebanyak n=2. Jadi jika n = 2, maka harga l = 0, 1 . Nah, dari sini dapat kamu ambil kesimpulan bahwa untuk atom dengan m=+1 dan l=1 harus memiliki setidaknya 2 buah kulit atom.
Soal ke 5
Apabila terdapat elektron yang memiliki kuantum utama (n) = 3. Tentukan bilangan kuantum yang lainnya!
Pembahasan:
n = 3
l = 0, 1, 2
m = antara -1 dan +1
Untuk nilai l = 2 maka nilai m = -2, -1, 0, +1, +2
Soal ke 6
Tentukan konfigurasi elektron dari 47 X!
Jawabannya:
Konfigurasi dari elektronnya adalah = (X) 5s1 3d10
Nah, hal pertama yang dilakukan yaitu dengan mengambil bagian paling akhir (3d10). Jika lapisan kulit terakhir adalah 3, maka n =3. Kemudian, mencari azimuth quantum dengan mengurutkan dari lapisan paling luar.
Karena memang azimuth sama dengan d, maka jawabannya adalah 2. Selanjutnya, mencari magnetic quantum, kamu dapat melihat bahwa lapisan quantum paling dalam adalah d sehingga m adalah +2. Langkah terakhir, menentukan spin quantum, maka jawabannya d sama dengan -½.
Jadi, jawaban dari soal tersebut adalah n = 3, m = 0, l = 1, dan s = -½.
Cukup Mudah Bukan Mempelajari Bilangan Kuantum?
Dari penjelasan di atas, apakah kamu sudah paham mengenai bilangan kuantum? Selain pengertian dan jenis-jenisnya, dengan mempelajari contoh soal-soalnya semoga bisa membantumu lebih memahami quantum number secara mendalam.Jika kamu tertarik dengan pelajaran kimia, kamu dapat mengasah otak kamu dengan mengganti contoh soal dengan atom lainnya loh. Selain itu, perbanyak membaca dan mengerjakan soal-soal mengenai quantum number agar kamu lebih memahaminya.