Selama ini, Anda mungkin sering mendengar istilah sel volta dan sel elektrolisis dalam ilmu pengetahuan kimia dan teknologi. Keduanya berperan penting dalam menghasilkan listrik. Namun, tahukah Anda bahwa terdapat perbedaan sel volta dan sel elektrolisis yang signifikan dalam berbagai aspeknya?
Untuk mengetahui jawabannya, yuk simak artikel ini. Sebab, di sini Anda akan menggali lebih dalam tentang 7 perbedaan sel volta dan sel elektrolisis. Selain itu, Anda juga akan mempelajari reaksi redoks yang mendukung penjelasan keduanya.
Sekilas tentang Reaksi Redoks (Reduksi-Oksidasi)
Sebelum Anda masuk ke pembahasan terkait perbedaan antara sel volta dan sel elektrolisis, mari bahas konsep dasar tentang reaksi redoks. Sebab, reaksi redoks menjadi dasar dalam pembentukan listrik pada sel volta dan sel elektrolisis.
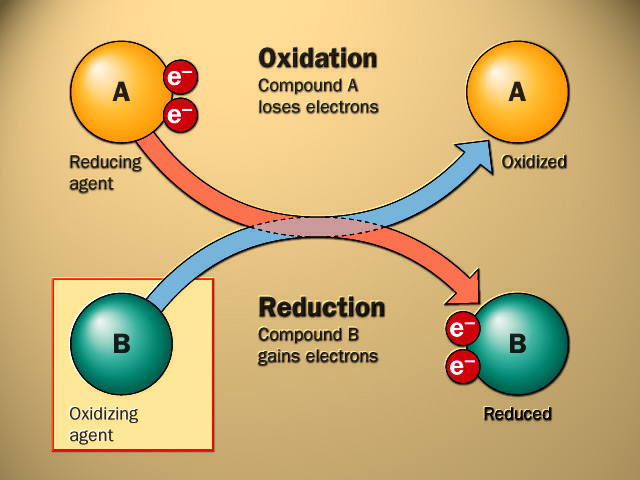
Reaksi redoks (reduksi-oksidasi) adalah jenis reaksi kimia yang melibatkan proses transfer atau perpindahan elektron dari satu zat ke zat lain. Sehingga, satu zat akan kehilangan elektron (oksidasi) dan zat lain akan mendapat elektron (reduksi).
Ketika suatu atom atau ion mengalami oksidasi, jumlah elektron yang ia miliki akan berkurang. Oksidasi biasanya terjadi ketika atom atau ion berinteraksi dengan zat lain yang lebih cenderung menerima elektron.
Sedangkan ketika suatu atom atau ion mengalami reduksi, jumlah elektron yang dimilikinya akan bertambah. Maksudnya, reduksi akan terjadi ketika suatu zat berinteraksi dengan zat lain yang lebih cenderung melepaskan elektron, sehingga zat tersebut menerima elektron.
Apa Itu Sel Volta?
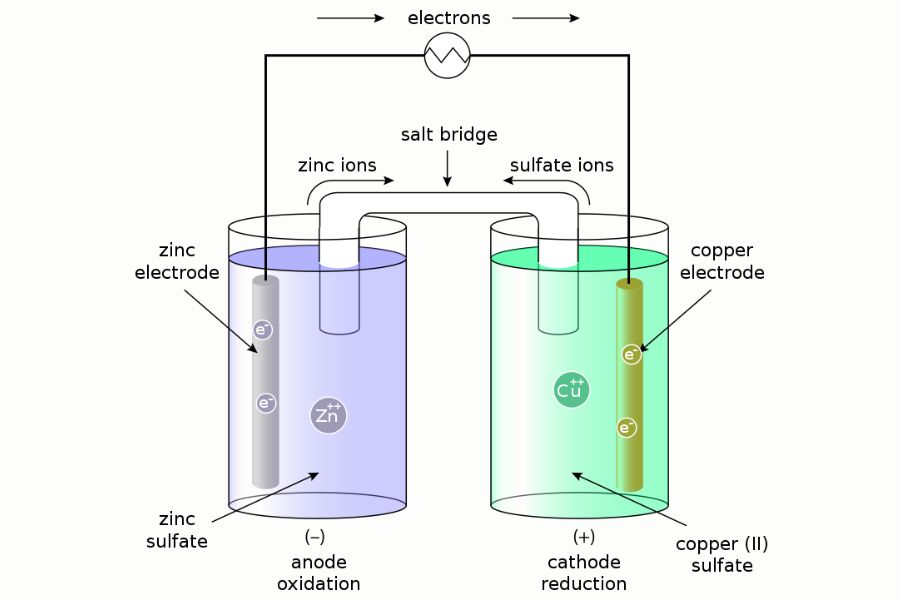
Penemuan sel volta berawal dari seorang ilmuwan Italia bernama Alessandro Volta pada tahun 1800. Ia memperkenalkan sel volta atau sel galvanik sebagai suatu perangkat elektrokimia yang mengubah reaksi redoks menjadi energi listrik secara spontan.
Salah satu perbedaan karakteristik utama dari sel volta dan sel elektrolisis adalah bahwa reaksi kimia di dalamnya terjadi secara spontan tanpa memerlukan catu daya eksternal. Kemudian, sel volta memiliki dua elektroda yang terbuat dari dua jenis logam yang berbeda dan ditempatkan dalam larutan elektrolit.
Nah, diantara dua elektroda tersebut, terjadilah reaksi redoks di mana satu elektroda akan melepaskan elektron (proses oksidasi) dan elektroda lainnya akan menerima elektron (proses reduksi). Aliran elektron dari satu elektroda ke elektroda lain itulah yang menghasilkan arus listrik.
Contoh sederhana dari sel volta adalah sel seng-copper (Cu-Zn) yang terdiri dari dua elektroda, yaitu elektroda seng (Zn) dan elektroda tembaga (Cu) yang mana terendam dalam larutan elektrolit. Sel Cu-Zn tersebut terhubung langsung melalui sirkuit eksternal.
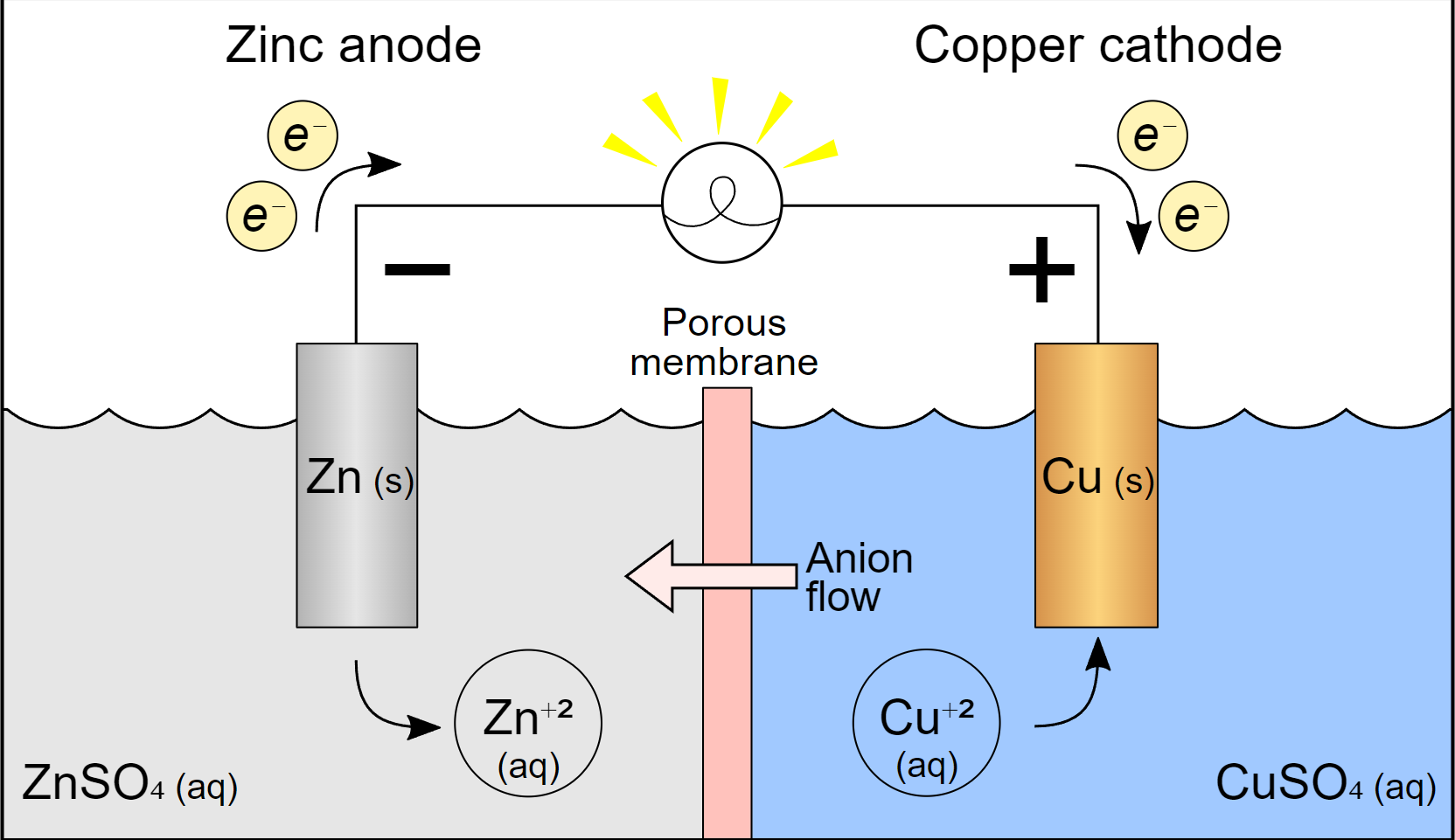
Dalam reaksi sel Cu-Zn, seng mengalami oksidasi dan melepaskan elektron. Sedangkan tembaga menerima elektron, yang mana berarti tembaga mengalami reduksi. Kemudian, aliran elektron yang dihasilkan seng ke tembaga melalui sirkuit eksternal dapat berguna untuk menggerakkan perangkat elektronik seperti lampu.
Apa Itu Sel Elektrolisis?
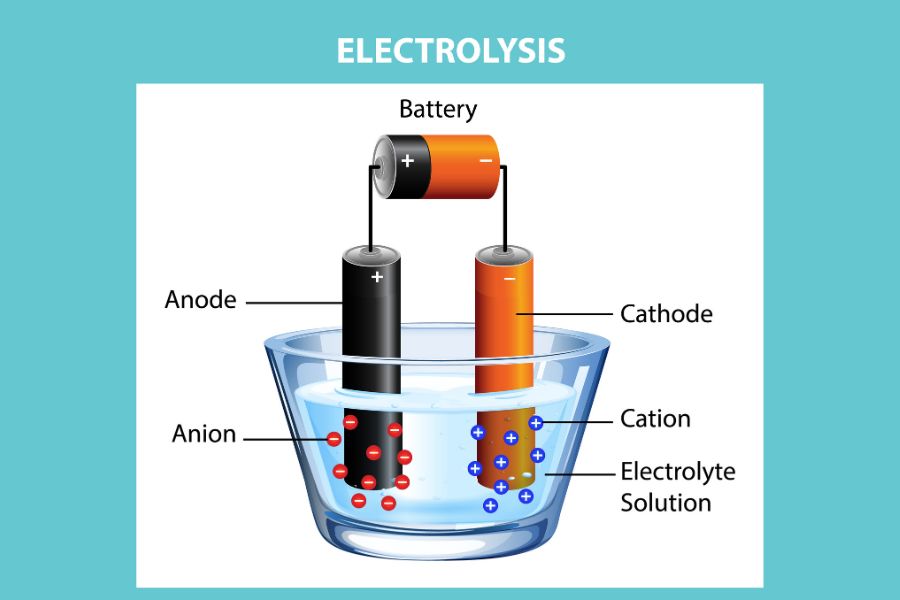
Perbedaan sel elektrolisis dan sel volta terletak pada definisinya di mana sel elektrolisis adalah jenis sel elektrokimia yang berfungsi untuk memaksakan reaksi redoks yang tidak akan terjadi secara spontan.
Sehingga, sel elektrolisis memerlukan energi listrik dari catu daya eksternal untuk memicu reaksi kimia tersebut. Meski begitu, proses elektrolisis juga bergantung pada prinsip dasar reaksi redoks di mana satu zat mengalami oksidasi sementara zat lain mengalami reduksi.
Sel elektrolisis juga memiliki dua elektroda yang mana terbuat dari konduktor inert yang tidak bisa bereaksi. Kemudian, diantara kedua elektroda ini, terdapat larutan elektrolit atau zat cair yang mengandung ion-ion. Ketika arus listrik mengalir melalui larutan elektrolit, maka ion-ion akan bergerak dan mengalami reaksi redoks.
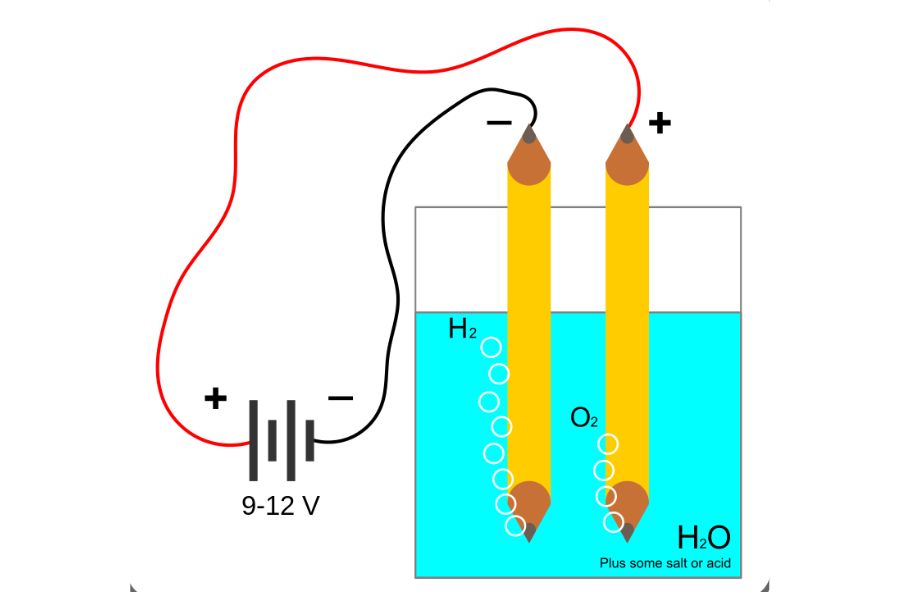
Contohnya, dalam elektrolisis air (H2O), molekul air terpecah menjadi gas hidrogen (H2) dan oksigen (O2) ketika arus listrik mengalir melalui larutan elektrolit. Proses ini sangat penting dalam pembuatan hidrogen sebagai bahan bakar alternatif yang bersih dan ramah lingkungan untuk kebutuhan transportasi dan pembangkit listrik.
7 Perbedaan Sel Volta dan Sel Elektrolisis dan Contohnya
Berdasarkan definisinya di atas, apa saja 7 perbedaan utama di antara sel volta dan sel elektrolisis dalam berbagai aspek dan bagaimana contohnya? Ketahui jawabannya di bawah ini:
1. Jenis Muatan Elektroda
Perbedaan pertama adalah elektroda dalam sel volta terbuat dari dua jenis logam yang berbeda, seperti tembaga dan seng. Salah satu elektroda akan menjadi katoda (menerima elektron) dan yang elektroda lainnya adalah anoda (kehilangan elektron). Contohnya seperti sel volta Cu-Zn yang telah kita bahas sebelumnya.
Sementara itu, elektroda pada sel elektrolisis adalah konduktor inert seperti platinum. Maka, tidak ada perbedaan signifikan dalam jenis logam elektrodanya.
2. Reaksi yang Terjadi
Kemudian, sel volta memanfaatkan reaksi redoks spontan antara dua logam dan larutan elektrolit. Reaksi tersebut menghasilkan aliran elektron dari anoda ke katoda melalui sirkuit eksternal. Contohnya, dalam sel volta Cu-Zn, seng teroksidasi menjadi seng ion (Zn2+) dan tembaga ion (Cu2+) tereduksi menjadi tembaga.
Sedangkan sel elektrolisis memaksakan reaksi redoks yang tidak akan terjadi secara spontan. Sebagai contoh, dalam elektrolisis air, larutan air (H2O) dipaksa untuk terpecah menjadi hidrogen (H2) dan oksigen (O2) melalui penggunaan energi eksternal (listrik).
3. Keberadaan Jembatan Garam
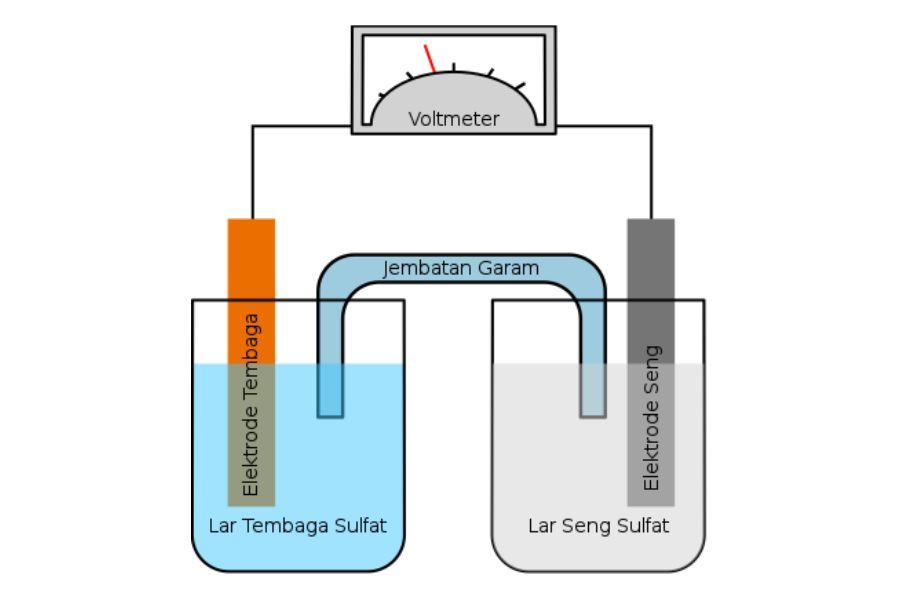
Perbedaan sel volta dan sel elektrolisis selanjutnya adalah kondisi sel volta yang tidak memerlukan jembatan garam. Aliran ion antara elektroda terjadi melalui larutan elektrolit yang memisahkan kedua elektroda. Misalnya, dalam sel volta Cu-Zn, larutan elektrolit adalah larutan yang mengandung ion-ion tembaga dan seng.
Sementara itu, sel elektrolisis memerlukan jembatan garam atau membran ionik untuk menghubungkan antara dua elektroda. Jembatan garam tersebut berfungsi agar ion-ion yang terbentuk pada elektroda tidak bercampur.
4. Potensial Sel Standar
Besaran potensial sel standar mengukur potensial listrik yang sel hasilkan saat kondisi standar (konsentrasi 1 Molar dan tekanan 1 atm) pada suhu. Pada sel volta, potensial sel standar positif menunjukkan bahwa sel dapat menghasilkan listrik secara spontan. Contohnya, sel volta Cu-Zn memiliki potensial sel standar positif.
Berbeda dengan sel volta, dalam sel elektrolisis, potensial sel standar negatif menunjukkan bahwa sel tersebut memerlukan energi eksternal untuk memaksakan reaksi agar berlangsung.
5. Arah Aliran Elektron
Selain itu, perbedaan lain dari sel volta dan sel elektrolisis juga terlihat dari arah aliran elektron dalam sel volta di mana berlangsung dari anoda ke katoda, lalu melewati sirkuit eksternal.
Arah aliran elektron yang seperti ini merupakan arah aliran elektron yang menghasilkan aliran listrik yang dapat berguna untuk melakukan pekerjaan. Sebagai contoh, pada sel volta Cu-Zn, elektron mengalir dari seng (anoda) ke tembaga (katoda).
Sementara dalam sel elektrolisis, arah aliran elektronnya adalah dari katoda ke anoda. Karena arah aliran yang seperti ini tidak alami, maka sel elektrolisis memerlukan energi eksternal.
6. Jenis Konversi Energi
Perbedaan selanjutnya dari sel volta dan sel elektrolisis adalah pada perubahan energinya. Sel volta mengonversi energi kimia menjadi energi listrik. Namun, sel elektrolisis, sebaliknya, mengonversi energi listrik menjadi energi kimia.
Reaksi redoks yang terjadi di dalam sel volta menghasilkan potensial listrik yang dapat berguna untuk berbagai kebutuhan. Contohnya adalah baterai alkali di dalam perangkat elektronik.
Sedangkan pada sel elektrolisi, suplai energi listrik dari luar berguna untuk memaksakan reaksi redoks yang tidak akan terjadi secara spontan. Contohnya pada elektrolisis air di mana air menggunakan suplai energi listrik dari luar untuk memecah atom hidrogen.
7. Kegunaan
Perbedaan terakhir terletak pada aspek aplikasinya. Sel volta seringkali bermanfaat untuk berbagai aplikasi, misalnya baterai yang digunakan dalam perangkat elektronik seperti ponsel dan laptop. Selain itu, sel volta juga berguna dalam eksperimen laboratorium untuk menghasilkan potensial listrik.
Namun di sisi lain, sel elektrolisis juga memiliki banyak aplikasi penting. Contohnya pada produksi logam murni, pemurnian logam, dan produksi bahan kimia. Selain itu, sel elektrolisis juga berguna dalam pengolahan limbah dan produksi hidrogen sebagai bahan bakar alternatif.
Sudah Paham Perbedaan Sel Volta dan Sel Elektrolisis?
Kesimpulannya, meskipun sama-sama sel elektrokimia, tetapi terdapat perbedaan yang signifikan antara sel volta dan sel elektrolisis. Mulai dari dalam hal jenis elektroda, reaksi yang terjadi, keberadaan jembatan garam, potensial sel standar, arah aliran elektron, jenis konversi energi, dan kegunaannya.
Untuk memudahkan pemahaman, Anda harus ingat bahwa sel volta menghasilkan listrik secara spontan, sementara sel elektrolisis memerlukan energi eksternal untuk memaksa reaksi kimia. Dengan pemahaman mendalam tentang kedua jenis sel ini, Anda dapat mengembangkan teknologi berkelanjutan untuk masa depan.
Misalnya membuat bahan bakar alternatif yang lebih bersih dan berkelanjutan, di mana juga akan membawa dampak positif untuk lingkungan alam dan kualitas hidup. Menarik, bukan?