Larutan buffer mungkin tidak terdengar seperti bahan kimia yang mengagumkan. Tetapi di dalam dunia ilmu pengetahuan dan laboratorium, serta dalam berbagai aspek kehidupan sehari-hari, mereka memiliki peran yang sangat penting.
Lantas, apa itu larutan buffer? Bagaimana prinsip kerjanya sehingga punya keistimewaan di dunia ilmu kimia? Cari tahu jawaban selengkapnya di artikel ini!
Apa Itu Larutan Buffer?
Larutan penyangga yang juga dikenal sebagai larutan buffer adalah suatu larutan yang menjaga stabilitas pH (konsentrasi ion hidrogen), terutama ketika ada penambahan zat yang mengandung sedikit asam atau sedikit basa.
Dalam larutan penyangga, terdapat kombinasi pasangan asam dan basa lemah yang memungkinkan larutan untuk menghadapi perubahan pH dengan sangat sedikit perubahan dalam nilai pH sebenarnya. Sebut saja ketika air murni ditambahkan zat asam maupun basa, pH dalam air akan berubah secara drastis.
Perubahan tersebut terjadi karena air murni tidak memiliki kemampuan untuk menyeimbangkan pH. Ketika memasukkan zat yang mengandung asam, maka pH air murni tersebut menurun menjadi 3.0. Jika air murni diberi zat yang mengandung zat basa, maka pH akan meningkat menjadi 11.0.
Fungsi dan Prinsip Kerja Larutan Buffer
Secara umum, larutan penyangga berfungsi untuk mempertahankan keseimbangan pH suatu larutan. Setiap ada penambahan zat yang memiliki sifat asam, basa, dan pengenceran ke dalam suatu larutan, maka penyangga akan membentuk suatu sistem untuk mempertahankan pH.
Dengan kata lain, fungsi larutan penyangga adalah untuk menjaga pH larutan walaupun ada pengaruh penambahan zat lain. Nah, dari penjabaran tersebut, prinsip kerja larutan buffer mengacu pada prinsip hukum Le Chatelier.
Prinsip tersebut menjelaskan bahwa larutan penyangga memicu terbentuknya keseimbangan pada reaksi asam lemah dengan basa kuat atau basa lemah dengan asam kuat. Reaksi kimia yang terjadi mengakibatkan terjadinya keseimbangan, tetapi konsentrasi yang dimiliki oleh ion hidrogen (H+) tetap stabil.
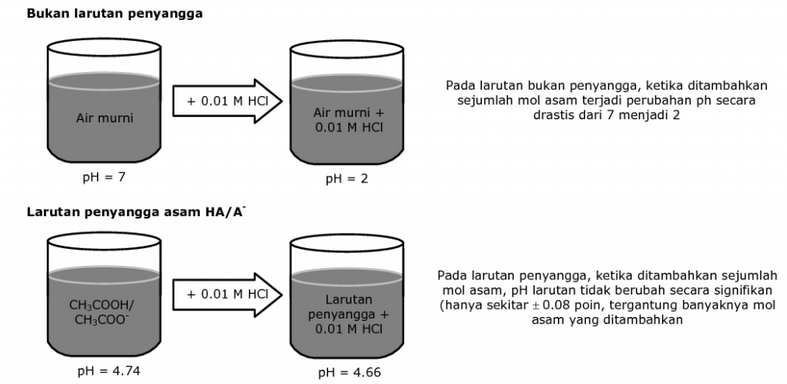
Sebagai contoh, larutan buffer asam asetat-asetat natrium memiliki asam asetat (CH₃COOH) dan ion asetat (CH₃COO⁻). Ketika asam ditambahkan ke larutan ini, ion asetat akan bereaksi dengan asam, membentuk lebih banyak asam asetat. Ini mengurangi kenaikan pH yang signifikan.
Cara Pembuatan Larutan Buffer
Selanjutnya adalah proses terbentuknya suatu larutan yang dapat menyeimbangkan pH. Terdapat dua cara pembuatan larutan penyangga, berikut ini penjelasannya:
1. Cara Langsung
Pertama, pembuatan larutan penyangga dapat dilakukan dengan cara langsung. Dalam metode ini, syarat terbentuknya larutan buffer adalah dengan mencampurkan asam lemah dengan garam (basa konjugasi) atau basa lemah dengan garam (asam konjugasi).
Untuk mendapatkan pemahaman yang lebih baik, mari kita amati bagaimana asam cuka bereaksi dengan garam dalam contoh berikut ini:
CH3COOH (aq) + CH3COONa (aq) / (CH3COO)2Ca (aq) (I)
NH3 (aq) + NH4Cl (aq) / (NH4)2SO4 (II)
Dari persamaan di atas, dapat diketahui bahwa persamaan (I) memiliki basa konjugasi CH3COO– yang diperoleh dari garam CH3COONa atau (CH3COO)2Ca. Sedangkan untuk persamaan (II) memiliki asam konjugasi NH4+ dari garam NH4Cl atau (NH4)2SO4.
2. Cara Pembuatan Larutan Buffer Secara Tidak Langsung
Selain itu, satu metode alternatif dalam pembuatan larutan penyangga adalah melalui pendekatan tidak langsung. Langkah-langkahnya adalah dengan mencampurkan asam lemah berlebih dengan basa kuat, sehingga menghasilkan garam yang merupakan basa konjugasi dari asam lemah.
Sebaliknya, ketika Amda mencampurkan basa lemah berlebih dengan asam kuat, maka akan menghasilkan garam dengan asam konjugasi dari basa lemah. Berikut ini contohnya:
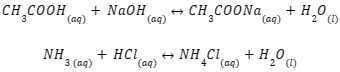
Cara kedua ini harus menghasilkan sisa dari asam lemah atau basa lemah. Dari persamaan tersebut, CH3COOH (asam lemah) dan NH3 (basa lemah) masih tersisa, sedangkan NaOH dan HCl habis bereaksi.
Jadi, garam yang terbentuk dari CH3COONa mengandung basa konjugasi. Sedangkan garam dari NH4Cl mengandung asam konjugasi.
Jenis-Jenis Larutan Buffer dan Cara Kerjanya
Komponen larutan penyangga terbagi menjadi dua jenis, yaitu larutan penyangga asam dan larutan penyangga basa. Langsung saja, ikuti penjelasan selengkapnya berikut ini:
1. Larutan Buffer Asam

Berdasarkan definisi di atas, larutan penyangga asam berfungsi untuk mempertahankan pH dalam kategori asam, yaitu pH kurang dari 7.0 (pH < 7). Buffer asam tersusun atas asam lemah dengan garamnya (basa konjugasi).
Cara kerja dan pembuatan larutan penyangga asam dalam larutan yang mengandung CH3COOH dan CH3COO– dapat ditemukan reaksi kesetimbangan kimia seperti berikut:
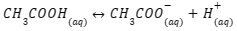
1. Penambahan Asam
Ketika terjadi penambahan asam (ion H+), maka reaksi kesetimbangan bergeser ke kiri (arah reaktan). Berdasarkan ara pergerakannya, ion H+ akan dinetralisasi oleh CH3COO– sehingga terbentuk molekul CH3COOH.
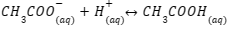
2. Penambahan Basa
Berbeda dengan asam, penambahan basa atau ion OH– akan bereaksi dengan ion H+ dan membentuk molekul air. Hal itu menyebabkan keseimbangan reaksi bergeser ke kanan (arah produk). Dengan begitu, larutan buffer dapat mempertahankan konsentrasi ion H+.
Selain itu, penambahan basa ini menyebabkan berkurangnya komponen asam pada asam lemah, sehingga reaksi bergerak ke arah kanan. Dengan kata lain, penambahan basa akan dinetralisasi oleh asam lemah sehingga membentuk CH3COO– dan molekul air. Supaya lebih jelas, cermati persamaan berikut ini:
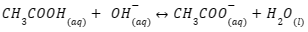
3. Pengenceran
Jika suatu reaksi ditambahkan air, maka menyebabkan derajat ionisasi dan jumlah ion H+ pada CH3COOH bertambah. Meskipun reaksi pengenceran itu menyebabkan volumenya bertambah, hal tersebut tidak mengubah jumlah konsentrasi H+, sehingga nilai pH larutan tidak berubah.
2. Larutan Buffer Basa
Larutan penyangga basa berfungsi untuk mempertahankan pH dalam suasana basa, yaitu lebih dari 7.0 (pH > 7). Buffer basa dapat dibuat dengan cara mencampurkan basa lemah dengan asam konjugasinya.
Contohnya adalah larutan yang mengandung NH4+ dan NH3. Keduanya akan terbentuk reaksi kesetimbangan seperti berikut:
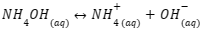
1. Penambahan Asam
Apabila terjadi penambahan asam, maka kelebihan ion H+ akan mengikat OH–, sehingga keseimbangan bergeser ke arah kanan. Dengan begitu, konsentrasi OH– dapat dipertahankan.
Penambahan ion H+ bereaksi dengan basa lemah (NH3), sehingga membentuk NH4+ yang merupakan asam konjugasi. Berikut persamaan reaksinya:
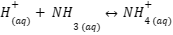
2. Penambahan Basa
Jika yang ditambahkan adalah basa, maka reaksi bergeser ke arah kiri (reaktan), sehingga larutan buffer dapat mempertahankan pH pada ion OH–. Oleh karena itu, pada kesetimbangan baru dapat mempertahankan pH.
Penambahan ion OH– akan bereaksi dengan komponen asam konjugasi membentuk basa lemah dan molekul air. Persamaan reaksi penambahan basa dalam buffer basa adalah sebagai berikut:
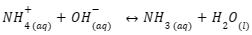
3. Pengenceran
Seperti halnya pada asam, penambahan air pada reaksi larutan penyangga basa tidak berarti. Meskipun derajat ionisasi, jumlah ion OH–, dan volume larutan bertambah, hal tersebut tidak mengubah pH larutan, sehingga pH tetap bisa dipertahankan.
Rumus Perhitungan pH Larutan Buffer
Perhitungan pH pada larutan penyangga dibedakan menjadi dua, yaitu perhitungan buffer asam dan buffer basa. Larutan yang bersifat asam dapat menggunakan rumus berikut ini:
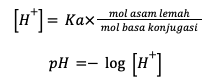
Sedangkan untuk perhitungan larutan penyangga yang bersifat basa menggunakan rumus berikut:
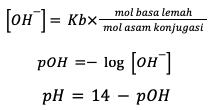
Keterangan:
- Ka = Konstanta asam
- Kb = Konstanta basa
Contoh Soal Terkait Larutan Buffer
Untuk mendapatkan pemahaman yang lebih dalam, berikut ini adalah contoh soal terkait larutan buffer beserta penjelasan solusinya:
1. Contoh Soal 1
Jika 50 mL NH3 0.1 M dicampur dengan 100 mL NH4Cl 0.5 M dengan Kb 10^-5, maka pH larutannya adalah…
Penyelesaian:
- Menentukan mol basa lemah
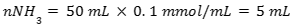
- Menentukan mol asam konjugasi
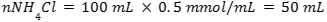
- Menghitung konsentrasi ion OH–

- Menghitung pH
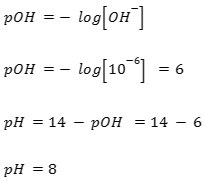
2. Contoh Soal 2
Tentukan campuran di bawah ini yang merupakan komponen larutan penyangga, kecuali
- NH4Cl dan NH3
- CH3COOK dan CH3COOH
- H2CO3 dan NaHCO3
- NaOH dan HCl
Penyelesaian:
Perlu Anda ingat bahwa komponen penyusun larutan buffer asam adalah asam lemah dengan garam atau asam lemah dengan basa kuat. Sedangkan penyusun buffer basa adalah basa lemah dengan garam atau basa lemah dengan asam kuat.
Jadi, sifat asam basa yang tertera pada soal adalah sebagai berikut:
| a) | NH4Cl | garam | NH3 | basa lemah |
| b) | CH3COOK | garam | CH3COOH | asam lemah |
| c) | H2CO3 | asam lemah | NaHCO3 | garam |
| d) | NaOH | basa kuat | HCl | asam kuat |
Jawabannya adalah yang D (NaOH dan HCl) karena keduanya tersusun atas basa kuat dan asam kuat.
Sudah Tahu Pentingnya Larutan Buffer dalam Kehidupan?
Selain rumus perhitungan pH, sudahkah Anda paham kira-kira apa saja peran larutan buffer atau penyangga dalam kehidupan sehari-hari? Anda harus paham peran serta aplikasi larutan penyangga, karena mereka termasuk ilmu yang tidak bisa terpisahkan oleh kehidupan sehari-hari.Larutan buffer sangat dibutuhkan oleh industri makanan dan minuman untuk mengontrol pH agar tidak terkontaminasi bakteri. Sedangkan dalam industri farmasi, larutan ini berguna agar zat aktif obat memiliki pH tertentu, dan pengelolaan limbah industri agar tidak mencemari kesehatan lingkungan.

