Pemahaman tentang struktur atom adalah salah satu tonggak penting dalam perkembangan ilmu kimia dan fisika modern. Selama berabad-abad, para ilmuwan telah mengajukan berbagai perkembangan model atom untuk menjelaskan bagaimana atom terbentuk dan berinteraksi.
Model-model ini telah mengalami perkembangan yang signifikan, seiring berjalannya waktu, dan telah melibatkan kontribusi para tokoh terkemuka dalam sejarah sains. Artikel ini akan membahas model atom dari para tokoh serta melihat kelebihan dan kekurangan dari masing-masing model tersebut.
Apa Itu Atom?
Atom adalah unit terkecil dari materi yang membentuk unsur kimia. Atom terbuat dari partikel fundamental yang disebut proton, neutron, dan elektron.
Proton dan neutron mengumpul bersama untuk membentuk inti pusat. Sedangkan di daerah seperti awan di sekitar nukleus, terdapat elektron yang bergerak. Mereka memiliki muatan listrik positif atau negatif dan bertanggung jawab untuk banyak reaksi kimia.
Pertama Kali Model Atom Itu Ada
Perkembangan model atom sebenarnya telah dikenalkan oleh seorang filsuf yang berasal dari Yunani bernama Democritus pada awal abad ke-4 sebelum masehi. Dia menyatakan bahwa semua materi terbuat dari sesuatu yang tak terpisahkan. Fakta tersebut berasal dari kata “atomos”, yang secara harfiah berarti tak terpisahkan
Democritus mengemukakan bahwa atom terdiri dari empat elemen yang berbeda, yaitu bumi, udara, api, dan air. Prinsip ini, menyebutkan atom berupa bola dengan ukuran yang berbeda.
Bola-bola atom bergerak di ruang angkasa, dan ketika tabrakan antar bola terjadi, maka atom dapat saling menempel, dan terjadi perubahan material.
Teori atom Yunani ini tidak didasarkan pada pengamatan alam, pengukuran, tes, atau eksperimen. Orang-orang Yunani hanya menggunakan matematika dan akal. Adanya pengaruh Aristoteles saat itu yang tidak setuju dengan Democritus, teori ini diabaikan hampir 2000 tahun.
Dari teori yang sudah ada, kemudian dikembangkan dari waktu ke waktu. Perkembangan model atom terdapat lima model, yaitu model atom Dalton, model atom Thomson, model atom Rutherford, model atom Bohr, dan model atom Schrodinger yang masing-masing terikat pada pemahaman atom pada saat itu.
5 Teori Perkembangan Model Atom
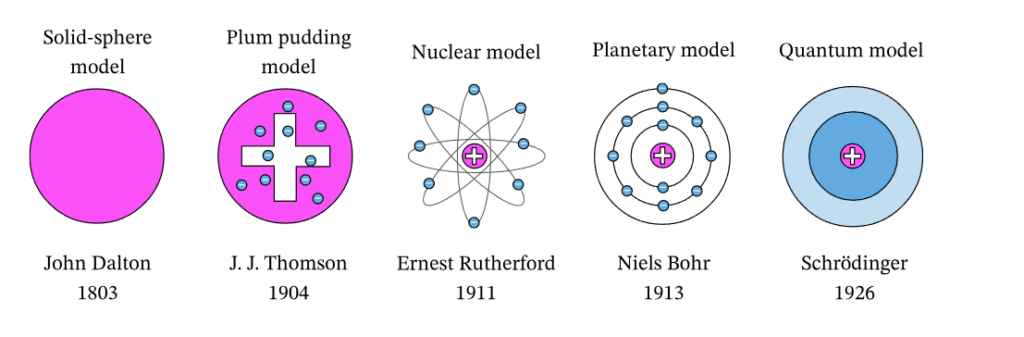
Berikut ulasan mengenai 5 jenis teori perkembangan pada model atom berdasarkan pemaparan dari tokohnya:
1. Model Atom Dalton (Model Bola Padat)

John Dalton adalah seorang ilmuwan Inggris yang mengubah filsafat atom Yunani, kemudian mengusulkan model atom modern pertama dan paling sederhana pada tahun 1803.
Postulat utama dari teori perkembangan model atom Dalton ini adalah:
- Semua materi terdiri dari sejumlah besar partikel sangat kecil yang disebut atom.
- Atom tidak dapat dibagi dan tidak dapat dihancurkan dalam reaksi kimia.
- Atom tidak dapat diciptakan atau dihancurkan, tetapi dapat diubah dari satu bentuk ke bentuk lainnya.
- Semua atom dari unsur-unsur tertentu adalah sama, yaitu identik dalam massa, ukuran, dan setiap aspek lainnya, namun berbeda dari atom-atom dari unsur-unsur yang lain.
- Atom terdiri dari unsur yang berbeda dan memiliki sifat, ukuran, dan massa yang berbeda dapat bergabung membentuk senyawa.
Model ini memiliki kelebihan dalam menjelaskan hukum-hukum dasar kimia, seperti hukum perbandingan tetap dan hukum perbandingan berganda. Namun, kekurangannya terletak pada ketidaktepatan dalam menjelaskan struktur internal atom dan fenomena atomik yang lebih kompleks.
2. Model Atom Thomson (Model Puding Plum)

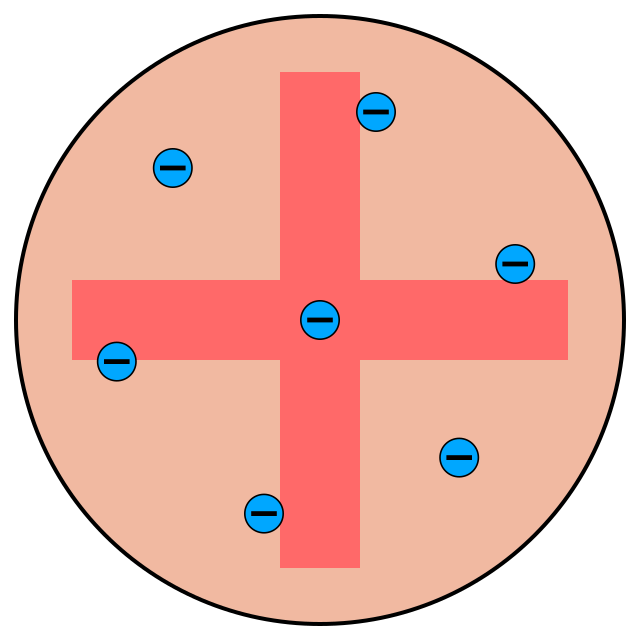
J.J. Thomson adalah tokoh yang memperkenalkan model atom “kue kismis” atau model atom “puding plum” pada tahun 1897. Menurut model ini, atom terdiri dari bola positif dengan elektron tersebar di dalamnya, seperti kismis dalam kue.
Pemahaman lain, yaitu elektron bermuatan negatif pada awan bermuatan positif seperti biji dalam semangka atau seperti plum pada puding.
Perkembangan model atom Thomson menjelaskan keberadaan muatan positif dan negatif, bahkan menjelaskan netralitas listrik materi dengan mengasumsikan muatan total elektron yang bermuatan negatif sama dengan total proton yang bermuatan positif.
Kelebihan dari model ini adalah menjelaskan fenomena penemuan elektron oleh Thomson dalam eksperimen tabung sinar katode. Selain itu, model ini secara inheren stabil. Maksudnya adalah jika elektron dipindahkan, mereka akan berusaha untuk kembali ke posisi semula.
Namun, kekurangan model ini adalah tidak menjelaskan bagaimana elektron dan partikel lainnya memiliki susunan yang teratur di dalam atom, dan tidak bisa memberikan dukungan eksperimental untuk model atomnya.
3. Model Atom Rutherford (Model Nuklir)

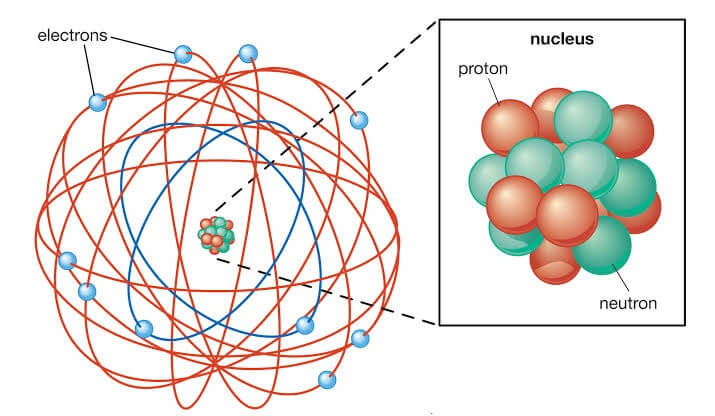
Ernest Rutherford melakukan eksperimen hamburan partikel alfa dan mengusulkan model atom yang mencerminkan hasil eksperimennya pada tahun 1911. Menurut perkembangan model atom ini, atom yang memiliki inti kecil terkonsentrasi di pusat dan elektron akan mengorbit di sekitarnya.
Percobaan Rutherford dengan cara memancarkan partikel-partikel alfa ini pertama kali melewati celah halus dan kemudian dibuat untuk menuju bagian kertas emas. Akibatnya, partikel-partikel ini tersebar dan menghasilkan kilatan terang pada layar melingkar yang dilapisi dengan zat yang disebut seng sulfida.
Eksperimen dilakukan pada foil tipis logam emas berat. Cara ini dilakukan dengan memancarkan dari unsur radioaktif yang tertutup dalam kotak timah.
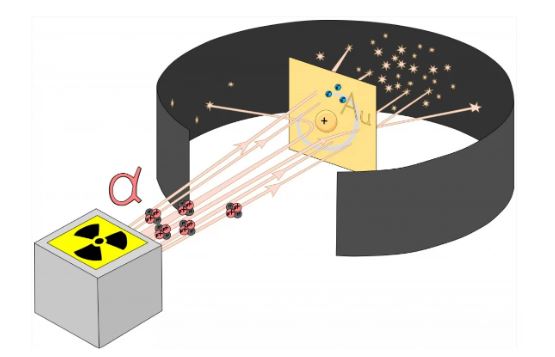
Hasil pengamatan dari eksperimen Rutherford:
- Sebagian besar partikel alfa mampu melewati kertas emas tanpa dibelokkan.
- Beberapa partikel alfa dibelokkan oleh sudut kecil.
- Sangat sedikit (satu dari sekitar 20000) partikel alfa mengalami defleksi besar dan bahkan kembali ke arah yang sama (180⁰).
Kelebihan perkembangan model atom ini adalah menjelaskan fenomena hamburan partikel alfa dan memberikan pemahaman yang lebih baik tentang struktur atom. Namun, kekurangannya adalah tidak menjelaskan mengapa elektron tidak runtuh ke inti karena adanya gaya elektromagnetik, dan tidak bisa menjelaskan stabilitas atom.
4. Model Atom Bohr (Model Planet)

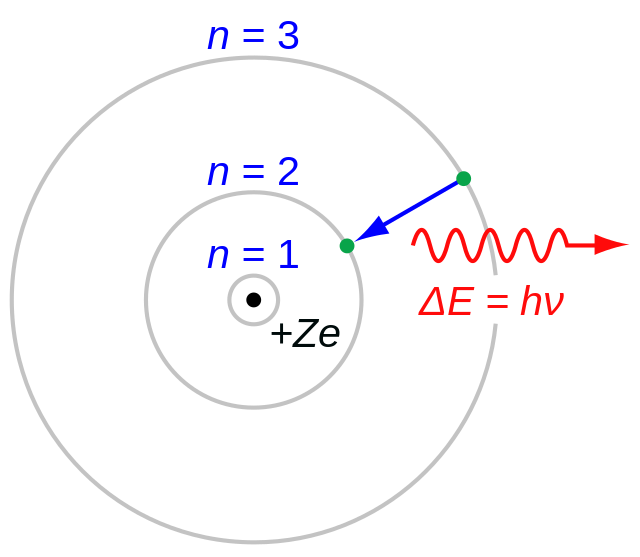
Niels Bohr memperkenalkan perkembangan model atom Bohr pada tahun 1913 yang membangun di atas model Rutherford. Menurut model ini, elektron hanya dapat mengorbit di sekitar inti atom dalam orbit diskrit dengan tingkat energi yang terdefinisi.
Neil Bohr menjelaskan stabilitas atom berdasarkan pengamatan eksperimennya. Menurutnya:
- Sebuah atom terdiri dari inti pusat yang sangat kecil, yang disebut nukleus. Nukleus membawa semua muatan positif dan sebagian besar massa atom.
- Elektron berputar di sekitar inti dalam jalur melingkar. Jalur melingkar ini disebut orbit. Gaya sentripetal yang diperlukan untuk gerakan melingkar disediakan oleh gaya tarik elektrostatik antara elektron dan inti.
- Elektron hanya dapat berputar dalam orbit tertentu yang diizinkan, yang disebut kulit atau tingkat energi, yang masing-masing dikaitkan dengan jumlah energi yang tetap.
- Sementara elektron berputar di orbit, ia tidak mendapatkan atau kehilangan energi. Oleh karena itu, orbit ini disebut keadaan stasioner atau tingkat energi.
- Sebuah elektron dapat melompat dari orbit energi yang lebih tinggi ke energi yang lebih rendah, sehingga memancarkan energi.
Untuk kenyamanan, tingkat energi ini diberi label K, L, M, N, dan sebagainya. Orbit yang paling dekat dengan nukleus adalah K kulit dan memiliki jumlah energi paling sedikit, dan elektron yang ada di dalamnya adalah K elektron, dan seterusnya dengan kulit berturut-turut dan elektronnya.
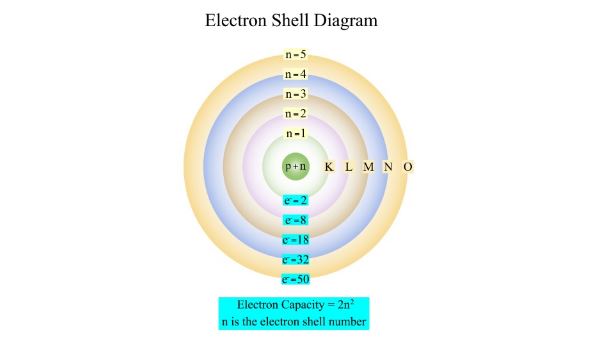
Model ini berhasil menjelaskan spektrum atom hidrogen dan memperkenalkan konsep kuantisasi energi. Kelebihan model ini adalah memberikan pemahaman yang lebih baik tentang stabilitas atom, tetapi kekurangannya adalah tidak dapat menjelaskan struktur atom yang lebih besar dan kompleks.
5. Model Atom Schrodinger (Model Kuantum)

Perkembangan model atom kuantum merupakan perkembangan lebih lanjut dari model atom Bohr yang diperkenalkan oleh sejumlah ilmuwan fisikawan Austria pada tahun 1926, yaitu Erwin Schrodinger.
Model ini didasarkan pada prinsip kuantum dan menjelaskan sifat partikel dan gelombang elektron secara simultan. Schrodinger mengusulkan bahwa, daripada elektron bergerak dalam orbit tetap atau kulit, elektron berperilaku sebagai gelombang.
Modelnya menunjukkan inti yang dikelilingi oleh awan kerapatan elektron. Awan ini adalah awan probabilitas. Meskipun kita tidak tahu persis di mana elektron berada, kita tahu mereka mungkin ditemukan di daerah ruang tertentu. Daerah ruang ini disebut sebagai orbital elektron.
Lebih singkatnya, model mekanika kuantum dijelaskan sebagai berikut:
- Elektron tidak bergerak di sekitar inti dalam orbit.
- Elektron ada di tingkat energi tertentu sebagai awan.
- Awan elektron adalah wilayah muatan negatif, yang mengelilingi nukleus.
- Orbital adalah wilayah dengan probabilitas tinggi mengandung elektron.
Model atom kuantum dapat memberikan gambaran yang akurat tentang struktur atom, energi elektron, dan hubungan dengan spektrum atom. Namun, kekurangannya adalah kompleksitas matematis yang terkait dengan pemecahan persamaan Schrodinger.
Bagaimana Pemahaman Kamu tentang Perkembangan Model Atom?
Dalam perkembangan model atom, perlu dicatat bahwa setiap model menggambarkan kemajuan ilmiah pada zamannya, sehingga memberikan kontribusi berharga dalam memahami struktur atom.
Masing-masing model memiliki kelebihan dan kekurangannya sendiri. Melalui proses yang berkesinambungan, kita dapat memperoleh pemahaman yang lebih baik tentang atom dan fenomena atomik yang terkait.
Seiring berjalannya waktu, penelitian dan eksperimen lebih lanjut terus dilakukan untuk memperbaiki dan memperluas pemahaman kita tentang struktur atom. Para ilmuwan juga terus mengembangkan model atom yang lebih akurat dan komprehensif.

