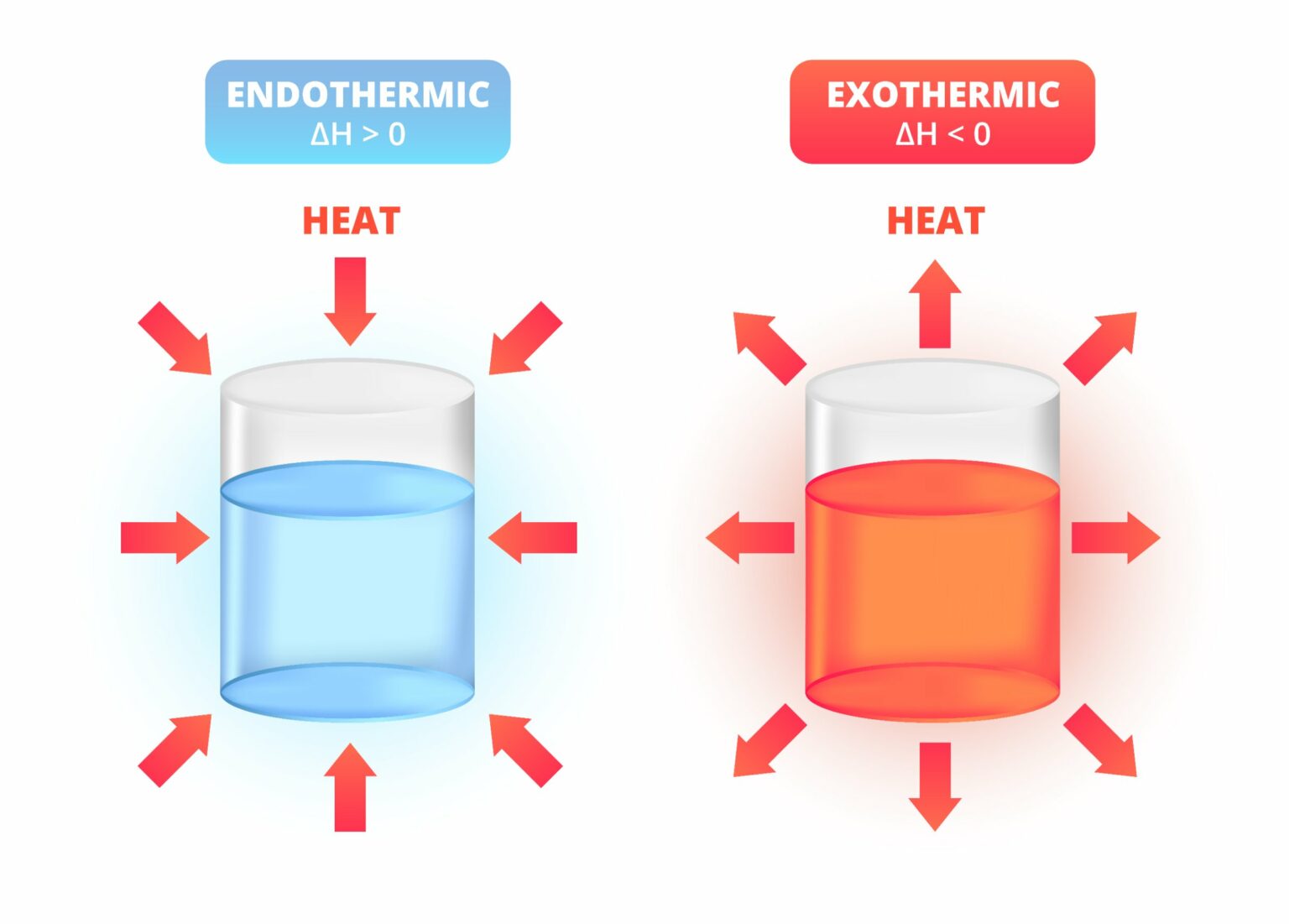
Dalam dunia ilmu kimia dan fisika, kita sering mendengar istilah eksoterm dan endoterm. Kedua istilah ini merujuk pada dua jenis reaksi kimia atau proses fisika yang berbeda.
Mengetahui perbedaan antara keduanya adalah hal yang penting untuk memahami berbagai fenomena alam yang terjadi di sekitar kita. Mari kita jelajahi lebih dalam tentang apa itu eksoterm dan endoterm, serta ciri, proses, dan perbedaan keduanya.
Apa Itu Eksoterm dan Endoterm?
Secara umum, berikut ini adalah penjelasan pengertian lengkap tentang eksoterm dan endoterm:
1. Pengertian Eksoterm
Reaksi eksoterm adalah reaksi kimia atau proses fisika di mana energi dilepaskan atau dibebaskan dalam bentuk panas. Kata “eksoterm” berasal dari bahasa Yunani, di mana “exo” berarti “keluar,” dan “therm” berarti “panas”.
Dalam reaksi eksoterm, energi yang dilepaskan oleh sistem lebih besar daripada energi yang diperlukan untuk memulai atau memicu reaksi. Hasilnya, suhu sekitar akan meningkat karena panas yang dilepaskan.
Energi eksoterm yang lepas disebabkan oleh pembentukan ikatan baru (produk) pada tingkat yang lebih tinggi. Sedangkan energi yang dibutuhkan untuk memecah ikatan (reaktan) lebih rendah. Pada akhir reaksi, perubahan entalpi juga menurun. Selama reaksi kimia, banyak energi diperlukan.
Energi ini berguna untuk mempertahankan ikatan yang menyatukan molekul. Sebagai hasil dari reaksi antara molekul dan senyawa, serta putusnya ikatan, sejumlah besar energi dilepaskan.
Contoh paling umum dari reaksi eksoterm adalah pembakaran. Ketika bahan bakar seperti kayu, bensin, atau gas alam bereaksi dengan oksigen di udara, mereka melepaskan energi panas, menyebabkan nyala api dan menghasilkan panas yang terasa.
2. Pengertian Endoterm
Sedangkan reaksi endoterm adalah reaksi kimia atau proses fisika di mana energi diserap atau diperlukan untuk memulai atau mempertahankan reaksi. Kata “endoterm” juga berasal dari bahasa Yunani, di mana “endo” berarti “di dalam.”
Dalam reaksi endoterm, energi yang dibutuhkan lebih besar daripada energi yang dihasilkan, sehingga mengakibatkan penurunan suhu di sekitar. Energi ini sebagai hasil dari reaksi reaktan ke dalam produk.
Kondisi ini terjadi sebagai akibat dari disosiasi ikatan antara molekul. Energi tersebut kemudian dilepaskan melalui pembentukan ikatan baru.
Panas diambil dari lingkungan dalam reaksi tersebut, sehingga suhu sistem di mana reaksi berlangsung tetap dingin. Juga, pada akhir reaksi, entalpi, yang merupakan perubahan energi panas selama konversi reaktan menjadi produk, meningkat.
Contoh reaksi endoterm adalah pengembunan es. Ketika air menguap dari permukaan daun atau jendela yang dingin, ia menyerap energi panas dari sekitarnya, dan akhirnya menyebabkan pengembunan air menjadi es.
Mengapa Panas Dilepaskan atau Diserap dalam Reaksi Kimia?
Dalam reaksi kimia apapun, ikatan kimia rusak atau terbentuk. Aturan praktisnya adalah ketika ikatan kimia terbentuk, maka panas dilepaskan. Sedangkan ketika ikatan kimia rusak, maka panas diserap. Begitu juga pada reaksi eksoterm dan endoterm.
Molekul secara inheren ingin tetap bersama, sehingga pembentukan ikatan kimia antar molekul membutuhkan lebih sedikit energi ketimbang dengan memutuskan ikatan antar molekul. Terutama pada molekul membutuhkan lebih banyak energi dan menghasilkan panas yang diserap dari lingkungan.
Ciri-Ciri Eksoterm dan Endoterm

Berdasarkan pengertian di atas, dapat terlihat bahwa eksoterm dan endoterm adalah dua istilah yang merujuk pada jenis reaksi kimia atau proses fisika yang melibatkan perubahan energi panas. Sehingga, ciri-ciri khas dari reaksi eksoterm adalah pelepasan energi panas dan peningkatan suhu di sekitar.
Contohnya pada pembakaran, dan reaksi eksoterm lainnya seperti reaksi kimia eksoterm. Kemudian, contoh khususnya adalah seperti reaksi pembakaran metana (CH4) dengan oksigen (O2) untuk menghasilkan karbondioksida (CO2) dan air (H2O).
Sedangkan ciri-ciri khas dari reaksi endoterm adalah penyerapan energi panas dan penurunan suhu di sekitar. Contohnya pada pengembunan es dan reaksi fotosintesis pada tumbuhan. Selain itu, contoh khususnya adalah reaksi penguraian kalsium karbonat (CaCO3) menjadi kalsium oksida (CaO) dan karbondioksida (CO2).
Proses Eksoterm dan Endoterm
Adapun detail proses dari fenomena eksoterm dan endoterm adalah sebagai berikut:
1. Proses Eksoterm
Proses eksoterm melibatkan pelepasan energi yang biasanya berupa panas. Reaksi eksoterm sering terjadi secara spontan karena energi yang dilepaskan oleh reaksi itu sendiri lebih tinggi daripada energi yang diperlukan untuk memicu reaksi.
Reaksi eksoterm sering bermanfaat dalam berbagai aplikasi sehari-hari. Seperti pemanasan ruangan menggunakan pemanas listrik atau pembakaran bahan bakar dalam mesin kendaraan.
2. Proses Endoterm
Proses endoterm memerlukan energi panas untuk memicu atau mempertahankan reaksi. Sebagai contoh, reaksi fotosintesis pada tumbuhan adalah salah satu proses endoterm yang penting.
Selama fotosintesis, tanaman menyerap energi cahaya matahari dan mengubahnya menjadi energi kimia dalam bentuk glukosa. Kemudian, tanaman akan menggunakan senyawa-senyawa tersebut untuk pertumbuhan dan perkembangannya.
Mengidentifikasi Perbedaan Dua Reaksi
Ada dua metode untuk membedakan antara reaksi eksoterm dan endoterm, antara lain:
1. Pantau Perubahan
Suhu ketika energi dilepaskan dalam reaksi eksoterm, suhu campuran reaksi meningkat. Ketika energi diserap dalam reaksi endoterm, suhu menurun. Anda dapat memantau perubahan suhu dengan menempatkan termometer dalam campuran reaksi.
2. Hitung Entalpi Reaksi (H)
Untuk mengklasifikasikan output energi bersih atau input reaksi kimia eksoterm dan endoterm, Anda dapat menghitung sesuatu yang disebut perubahan entalpi (ΔH) atau panas reaksi, yang membandingkan energi reaktan dengan energi produk.
Entalpi adalah ukuran energi internal. Jadi, ketika Anda menghitung perbedaan antara entalpi produk dan entalpi reaktan, Anda menemukan perubahan entalpi (ΔH), yang dapat direpresentasikan secara matematis sebagai:
ΔH = energi yang digunakan dalam pemutusan ikatan reaktan + energi yang dilepaskan dalam pembentukan
Nilai entalpi baik eksoterm dan endoterm ditambahkan dalam persamaan di atas. Karena menurut definisi, energi yang digunakan dalam pemutusan ikatan reaktan selalu positif (+) dan energi yang dilepaskan dalam pembuatan ikatan produk selalu negatif (-).
Jika ΔH negatif (-), maka reaksi kimia adalah eksoterm. Sebab, ada lebih banyak energi yang dilepaskan ketika produk terbentuk daripada energi yang digunakan untuk memecah reaktan.
Jika ΔH positif (+), maka reaksi kimianya adalah endoterm. Sebab, ada lebih sedikit energi yang dilepaskan ketika produk terbentuk daripada energi yang digunakan untuk memecah reaktan.
Diagram Energi
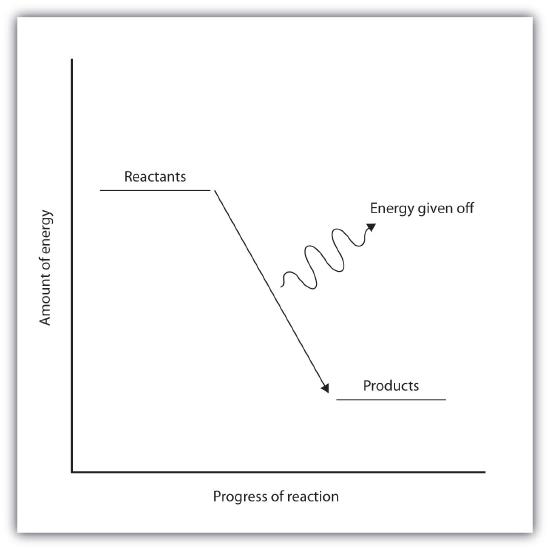
Reaksi eksoterm dan endoterm dapat secara visual diwakili oleh diagram tingkat energi. Dalam reaksi eksoterm, produk berada pada energi yang lebih rendah daripada reaktan.
Perbedaan antara energi reaktan dan energi produk disebut perubahan entalpi (∆H) reaksi. Pada reaksi eksoterm, perubahan nilai entalpi akan selalu negatif.
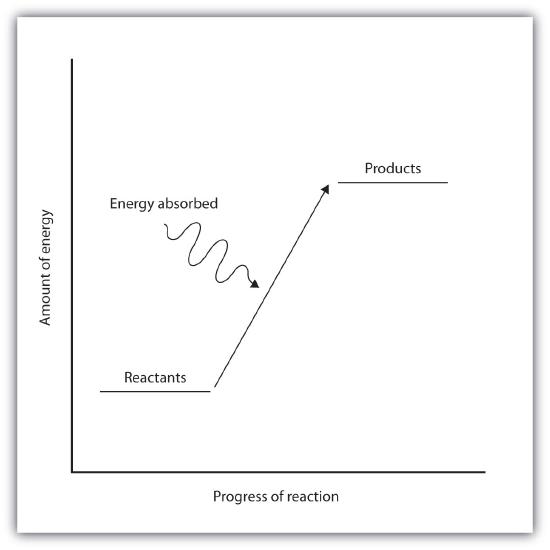
Sedangkan dalam reaksi endoterm, produk berada pada energi yang lebih tinggi daripada reaktan. Fakta ini berarti bahwa perubahan entalpi reaksi (∆H) adalah positif.
Perbedaan Antara Eksoterm dan Endoterm
Berikut adalah perbedaan utama antara eksoterm dan endoterm:
1. Pelepasan atau Penyerapan Energi
Pelepasan energi panas terjadi pada reaksi eksoterm. Sedangkan endoterm merujuk pada terjadinya menyerap energi panas.
2. Perubahan Suhu Sekitar
Eksoterm meningkatkan suhu sekitar karena pelepasan panas. Sementara endoterm menyebabkan penurunan suhu sekitar karena penyerapan panas.
3. Contoh Reaksi
Banyak hal penerapan reaksi eksoterm dan endoterm dalam kehidupan sehari-hari. Contoh eksoterm meliputi pembakaran, besi berkarat, pengendapan, ledakan, fisi nuklir, netralisasi reaksi antara asam dan basa, reaksi antara air dan kalsium oksida, dan berbagai reaksi kimia eksoterm.
Sedangkan contoh endoterm meliputi mencairnya es, penguapan, memasak, molekul gas, elektrolisis, dan proses fotosintesis pada tumbuhan.
4. Sifat Reaksi
Eksoterm cenderung lebih spontan karena energi yang dilepaskan melebihi energi yang diperlukan untuk memulai reaksi. Endoterm cenderung bersifat tidak spontan karena energi yang diperlukan lebih besar daripada energi yang dihasilkan.
5. Perubahan Entalpi
Entalpi perubahan pada reaksi eksoterm adalah negatif (-H). Sedangkan perubahan entalpi pada reaksi endoterm adalah positif (+H).
Sudah Lebih Paham dengan Reaksi Eksoterm dan Endoterm?
Berdasarkan penjelasan di atas, eksoterm dan endoterm adalah dua jenis reaksi kimia atau proses fisika dengan ciri khas pelepasan dan penyerapan energi panas. Eksoterm melepaskan panas dan meningkatkan suhu sekitar, sementara endoterm menyerap panas dan menyebabkan penurunan suhu sekitar.
Memahami perbedaan antara keduanya baik eksoterm dan endoterm, membantu kita dalam mengenali dan menjelaskan berbagai fenomena alam yang kita alami sehari-hari. Bahkan, konsep ini memiliki aplikasi luas dalam berbagai bidang, termasuk industri, teknologi, dan lingkungan. Dalam dunia industri, pemahaman tentang reaksi eksoterm dan endoterm membantu mengembangkan proses-proses produksi yang efisien dan aman. Sedangkan dalam bidang lingkungan, pemahaman ini membantu memahami reaksi kimia yang dapat memengaruhi keseimbangan ekosistem dan lingkungan.