Masih ingatkah dengan energi ionisasi? Jenis energi berupa gas ini hadir dalam kehidupan sehari-hari manusia. Di samping itu, materi tersebut juga termasuk dalam salah satu pembahasan pada mata pelajaran kimia di sekolah, lo.
Supaya tidak bingung dan lebih paham dengan konsep energi ini serta perhitungannya, pahami lebih dalam konsepnya lewat penjelasan berikut, yuk!
Apa yang Dimaksud Dengan Energi Ionisasi?
Pada dasarnya, energi ionisasi merupakan sebuah peristiwa pelepasan elektron dari sebuah kulit atom menjadi sebuah gas. Peristiwa pelepasan tersebut memerlukan sebuah energi yang biasa disebut dengan potensial ionisasi.
Selain itu, terdapat faktor lainnya yang memengaruhi perubahan besaran energi untuk melepaskan elektron tersebut. Salah satu faktor terpenting adalah sifat keperiodikan suatu unsur. Faktor ini memiliki peran penting untuk menentukan besaran elektron yang harus gugur sesuai dengan letak unsur tersebut.
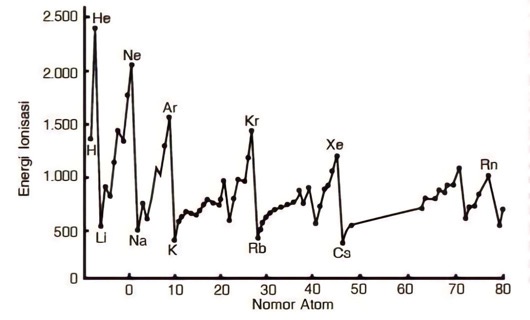
Jumlah besaran energi yang dibutuhkan untuk menggugurkan elektron bergantung pada seberapa jauh jarak inti atom dan elektron valensi. Dasar konsep perhitungannya adalah makin jauh jarak elektron dari inti atom, maka makin kecil energi potensial ionisasi nya.
Berdasarkan konsep tersebut, dapat diartikan bahwa makin keluar dari inti, maka gaya tarik pusat atom akan menjadi makin lemah. Oleh karena itu, peristiwa pelepasan elektron menjadi mudah saat jaraknya sudah jauh dari pusat atom. Karena tidak terikat dengan gaya tarik yang cukup kuat.
Sifat Keperiodikan Unsur
Sifat keperiodikan unsur merupakan suatu peristiwa perubahan sifat dengan kecenderungan yang beragam. Kecenderungan ini berguna untuk mengubah besaran energi saat pengeluaran elektron sesuai dengan ukuran jari-jari atom.
Sifat tersebut berguna dalam menentukan sifat dari unsur-unsur yang ada pada sistem periodik unsur. Selain itu, sifat keperiodikan unsur berkaitan langsung dengan energi ionisasi.
Faktanya, faktor yang memengaruhi sifat fisis pada sistem periodik unsur adalah potensial ionisasi. Energi ini dapat berubah sesuai dengan banyak atom yang terdapat pada satu unsur dan unsur yang lainnya. Di samping itu pula, banyaknya jumlah elektron yang ada pada suatu unsur dapat memengaruhi besaran energi pelepasan elektron dari inti atom.
Maka dari itu, sifat keperiodikan unsur ini memiliki kecenderungan penting terhadap perubahan energi ionisasi pada suatu unsur. Peristiwa ini disebabkan oleh posisi unsur yang ada pada sistem periodik memiliki angka berbeda yang menunjukkan jumlah elektron.
Berikut ini penjelasan tentang kecenderungan yang memengaruhi perubahan potensial ionisasi pada suatu unsur sesuai dengan sifat keperiodikan unsur.
1. Kecenderungan Terhadap Golongan
Jika dilihat dari posisi unsur dalam satu golongan, makin kebawah maka energi pelepasan elektron akan makin kecil. Alasannya, besar ukuran jari-jari atom membesar dan gaya tarik terhadap kulit elektron terluar akan mengecil. Akibatnya, energi yang dibutuhkan makin sedikit.
2. Kecenderungan Terhadap Periode
Untuk unsur yang berada pada satu periode, makin ke kanan energi yang dibutuhkan akan makin besar. Mengapa demikian? Penyebabnya adalah karena ukuran jari-jari atom mengecil dan mengalami pembesaran pada gaya tarik terhadap kulit atom terluar.
Pembesaran sekitar 0,65 per satuan unsur inilah yang yang mengakibatkan pengecilan pada ukuran jari-jari atom. Singkatnya, kelompok unsur alkali memiliki potensial ionisasi yang rendah. Sementara itu, energi tertinggi ada pada kelompok gas mulia.
Konsep Perhitungan Energi Ionisasi
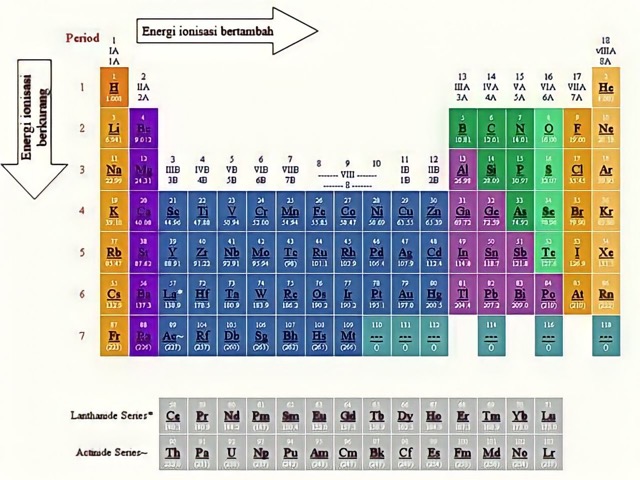
Konsep perhitungan energi ionisasi tidak akan selalu sama untuk masing-masing unsur. Selain itu, konsep yang berbeda juga akan berlaku untuk unsur yang berada pada periode yang sama.
Contohnya, konsep perhitungan untuk unsur-unsur yang satu periode yaitu makin kanan posisi suatu unsur pada tabel periodik, maka energi yang dibutuhkan akan makin besar. Kebalikannya berlaku untuk unsur yang mengarah ke kiri.
Alasan dari adanya konsep perhitungan seperti ini adalah makin mengarah ke kanan, maka unsur ion tersebut akan makin berdekatan dengan pusat atom. Oleh sebab itu, gaya tarik yang ada akan makin besar sehingga proses pembebasan ion akan makin sulit.
Kondisi tersebut tentunya membutuhkan energi pelepasan yang cukup besar.
Selain itu, jarak inti dan kulit terluar elektron yang makin berdekatan menyebabkan jari-jari atom akan makin mengecil. Maka dari itu, energi potensial ionisasinya akan membesar, karena kekuatan tarikan pusat atom makin kuat pula.
Bagaimana Cara Menghitung Satuan Energi Ionisasi?
Peristiwa pelepasan ion ini memiliki jenis yang berbeda berdasarkan urutan elektron yang dikeluarkan. Semisal, terdapat satu unsur ion yang akan dilepaskan, maka energi yang digunakan disebut dengan energi ionisasi pertama. Begitu pula dengan ion kedua, ketiga, dan seterusnya.
Situasi seperti ini disebabkan karena banyak atom netral yang keluar bersama dengan ion tersebut. Besaran atom netral pada elektron dipengaruhi oleh jumlah muatan dari masing-masing elektron yang akan dikeluarkan.
Contohnya, elektron pertama memiliki muatan lebih sedikit, sehingga nilai atom netral akan menyesuaikan besaran muatan tersebut. Akibatnya adalah adanya sifat efektivitas saat peristiwa pelepasan elektron terjadi.
Meskipun besaran energi yang dibutuhkan untuk melepaskan elektron terbilang lemah, namun masih tetap ada keterkaitan antara pusat atom dan elektron valensi. Dengan begitu, sifat dari hasil kebutuhan energi selalu bernilai positif.
Secara eksperimental, cara perhitungan besaran energi pelepasan elektron dapat Anda lakukan dengan menggunakan sebuah tegangan yang memiliki besaran Volt. Singkatnya, konsep satuan energi ionisasi adalah SI dan eV, dengan ketentuan 1 eV = 13,06 kkal/mol atau J = 96,485 kJ.mol-1.
Sesuai dengan konsep di atas, simbol satuan dari potensial ionisasi ini yaitu kJ mol-1 atau kilojoules per mole. Maka, besaran nilai yang didapat adalah 2370 untuk nilai tertinggi, dan 38 untuk nilai terendahnya.
Di sisi lain, gambaran dari perhitungan energi ionisasi adalah adanya penyesuaian dengan besar kekuatan elektron yang terikat dengan atom. Selain itu, besar kekuatan dari muatan pusat atom yang disimbolkan sebagai Zef juga memengaruhi daya terhadap pelepasan elektron terluar.
Lalu, gambaran konsep yang sesuai adalah besar energi ionisasi sangat bergantung pada gaya tarik yang ada. Gaya tarik ini disimbolkan sebagai Coulomb dengan nilai Zef yang rendah, dan ukuran jari-jari r yang membesar.
3 Contoh Soal dan Penjelasan Terkait Perhitungan Energi Ionisasi
Selanjutnya, agar dapat lebih paham tentang cara menghitung energi ionisasi dan bagaimana penerapan konsepnya, simak beberapa contoh soal yang ada di bawah ini!
1. Terdapat unsur-unsur AA, AB, AC, AD, AE yang berada pada satu golongan unsur.
Diketahui besar energi potensial ionisasi sebesar 56 kJ/mol, 183 kJ/mol, 118 kJ/mol, 254 kJ/mol, dan 63 kJ/mol secara berturut-turut. Tentukan urutan yang sesuai dengan kenaikan nomor atom dari unsur-unsur tersebut!
Jawaban:
AD-AB-AC-AE-AA
Pembahasan:
Pada dasarnya, besaran energi yang dibutuhkan akan makin mengecil menyesuaikan dengan nomor atom yang makin bertambah. Maka, soal di atas dapat dijawab dengan energi yang besar merupakan unsur dengan nomor atom yang kecil.
Jika dilihat dari besar energi nya, maka urutan dengan nilai potensial ionisasi terbesar adalah AA, AE, AC, AB, AD. Dengan begitu, dapat ditarik kesimpulan jika energi yang terbesar merupakan kebalikan dari nilai kenaikan nomor atom. Maka, jawaban soal di atas adalah AD, AB, AC, AE, AA.
2. Terdapat barisan unsur dengan nama FF, FG, FH, FI, FJ yang memiliki nomor atom secara berturut-turut yaitu 13, 16, 20, 35, 53.
Tentukan urutan yang benar berdasarkan besar energi terendah yang dibutuhkan!
Jawaban:
FJ-FH-FI-FF-FG
Pembahasan:
Penentuan konfigurasi elektron setiap unsur yaitu:
FF = 2, 8, 3
FG = 2, 8, 6
FH = 2, 8, 8, 2
FI = 2, 8, 18, 7
FJ = 2, 8, 18, 18, 8
Urutkan unsur-unsur secara berurutan berdasarkan dari besarnya jari-jari atom setiap unsur yang ada. Dengan demikian, akan didapatkan unsur FJ yang memiliki jari-jari terbesar dengan jumlah kulit atom sebanyak 5. Lalu, ada unsur FH dan FI yang sama-sama memiliki kulit sebanyak 4.
Hasilnya, posisi untuk unsur FI berada pada golongan VIIA. Sebaliknya, berbeda dengan unsur sebelumnya, unsur FH yang berada pada golongan IIA. Dengan begitu, telah didapatkan hasil dari unsur-unsur yang berada di satu periode dari arah kiri menuju kanan yaitu FH > FI.
Sedangkan untuk unsur yang lain seperti unsur FF dan FG yang berada pada satu periode yaitu periode ketiga, maka dapat diartikan bahwa FF > FG berdasarkan besar jari-jari atom nya. Hasilnya, sesuai dengan besar jari-jari atom didapatkan jawaban FG, FF, FI, FH, FJ.
Tetapi, jika dilihat kembali soal memerintahkan untuk mengurutkan nama unsur sesuai dengan besar energi ionisasi yang dibutuhkan. Oleh karena itu, sesuai dengan konsep di mana energi adalah kebalikan dari besar jari-jari atom, maka jawabannya adalah FJ, FH, FI, FF, FG.
3. Terdapat daftar energi pelepasan elektron pada unsur-unsur yang ada di kelompok golongan alkali yang ditulis secara acak.
Lalu, tentukan besar energi yang dibutuhkan untuk melepas elektron dari unsur K dan Rb secara berurutan!
A: 135 kJ/mol
B: 340 kJ/mol
C: 194 kJ/mol
D: 201 kJ/mol
E: 98 kJ/mol
Jawaban:
C dan D
Pembahasan:
Sesuai dengan tabel periodik, posisi unsur kelompok golongan alkali berada pada golongan IA. Sementara untuk urutan nama unsur kelompoknya adalah Li – Na – K – Rb – Cs secara berurutan. Urutan tersebut langsung dibalik arahnya karena menyesuaikan konsep nilai energi yang berbanding terbalik dari besar jari-jari atom.
Maka, hasil akhirnya adalah Cs – Rb – K – Na – Li. Maka, jawaban yang tepat adalah C dan D yang merupakan urutan dari unsur K dan RB secara berurutan.
Sudahkah Anda Lebih Paham Tentang Energi Ionisasi?
Secara garis besar, perhitungan besaran energi ionisasi sangat bergantung pada posisi sebuah unsur pada tabel periodik unsur kimia. Di samping itu, terjadi penyesuaian dengan konsep perhitungan yang sudah ada. Penyebabnya adalah pengaruh besarnya jari-jari atom dan gaya tarik yang disebabkan.
Oleh karena itu, dapat disimpulkan bahwa besar energi untuk melepaskan elektron keluar dari inti atom yaitu makin ke kanan posisi sebuah unsur, maka makin besar energi yang dibutuhkan. Selain itu, faktor lain seperti letak golongan dan periode sebuah unsur juga memengaruhi besaran energi yang akan timbul.

