Istilah “entalpi” akan sering muncul saat Anda mempelajari reaksi kimia dan hukum termodinamika terkait perubahan energi. Kaidah ini merujuk pada jumlah energi total yang mana menjadi konsep penting dalam termodinamika dan berkaitan dengan energi panas di dalam sistem kimia.
Jadi, mari kita pelajari secara rinci bagaimana konsep beserta jenis dan rumusnya. Kemudian, kita juga akan belajar menyelesaikan contoh soal dengan pembahasan yang sudah diberikan di artikel ini untuk menguji dan menajamkan pemahaman. baca artikel ini sampai habis, ya!
Definisi dan Konsep Entalpi
Secara umum, entalpi berhubungan dengan perubahan energi panas di dalam suatu sistem kimia. Namun, dalam konteks kimia, entalpi merujuk pada jumlah energi total dalam suatu sistem, termasuk energi panas dan kerja yang dilakukan oleh sistem tersebut.
Istilah ini berasal dari bahasa Yunani enthalpein yang berarti “terus-terusan”. Kaidah termodinamika ini sering digunakan untuk menggambarkan perubahan energi, tekanan panas, dan volume yang ada dalam proses fisik reaksi kimia suatu zat.
Sebagaimana yang Anda pahami bahwa dalam reaksi kimia, bentuk energi dapat Anda ubah dari energi ikatan antar atom menjadi energi kinetik, energi potensial, atau energi panas.
Nah, di sinilah fungsi jumlah perubahan energi total, yakni untuk mengukur perubahan energi total dalam suatu sistem selama proses tersebut terjadi. Konsep ini membantu menjelaskan mengapa beberapa reaksi melepaskan panas, sementara yang lain menyerapnya.
Entalpi (H) dinyatakan dalam satuan energi seperti joule (J) atau kalori (cal), tergantung pada sistem pengukuran yang digunakan. Namun dalam kimia, Anda mungkin akan lebih sering menggunakan kilojoule (kJ) atau kilokalori (kcal) karena skala energi yang besar dalam reaksi kimia.
Selain itu, perubahan energi bisa bersifat positif atau negatif tergantung pada apakah sistem menyerap atau melepaskan panas selama reaksi atau perubahan fase. Positif artinya sistem menjalankan reaksi endotermik, sedangkan negatif melambangkan bahwa reaksi tersebut eksotermik.
Reaksi eksotermik melepaskan panas ke lingkungan sekitarnya, sementara reaksi endotermik menyerap panas dari lingkungan. Maka dari itu, konsep jumlah energi total dalam sistem merupakan kunci utama dalam pemahaman perubahan energi panas dalam sistem kimia.
Rumus Entalpi (ΔH)
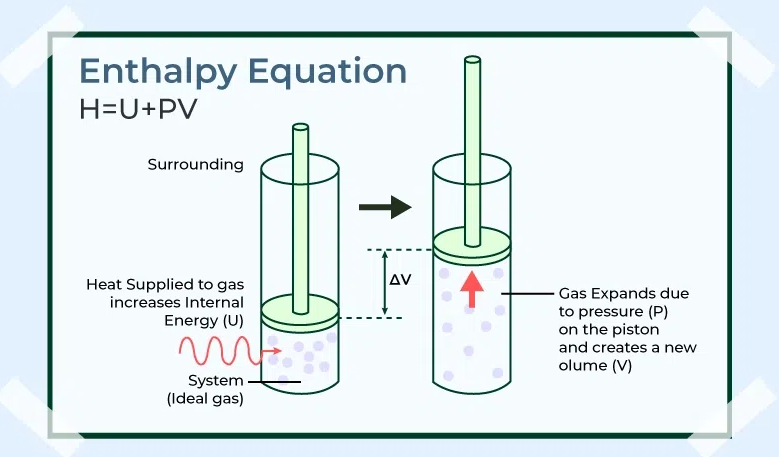
Berdasarkan penjelasan di atas, entalpi (H) mencerminkan jumlah energi yang dimiliki oleh suatu sistem kimia pada kondisi tekanan konstan. Sementara itu, perubahan entalpi (ΔH) merupakan selisih antara H produk dengan H reaktan dalam suatu reaksi.
Adapun rumus H adalah:
H = U + (P x V)
Dalam rumus tersebut, U adalah energi internal, sementara P adalah tekanan dan V adalah volume. Sementara rumus umum ΔH adalah sebagai berikut:
ΔH = Hfinal (produk) – Hinitial (reaktan)
Dalam rumus tersebut, Hfinal adalah H dari produk akhir. Sedangkan Hinitial adalah H dari reaktan awal.
Jenis-Jenis Entalpi dan Contohnya
Selanjutnya, kita akan membahas jenis-jenisnya untuk membantu menghitung ΔH guna menggambarkan berbagai proses dan reaksi. Berikut adalah beberapa jenisnya beserta contohnya yang umum:
1. Entalpi Reaksi (ΔHr)
Hukum reaksi termodinamika (ΔHr) ini mengukur perubahan energi panas dalam suatu reaksi kimia pada kondisi tekanan konstan. Jenis inilah yang paling sering kita lihat dalam reaksi kimia umum. Sebut saja reaksi pembakaran hidrogen yang memiliki nilai energi sebagai berikut:
2H2(g) + O2(g) → 2H2O(l)
ΔHr = -483.6 kJ/mol
2. Entalpi Pembentukan (ΔHf)
Selain itu, terdapat ΔHf atau reaksi pembentukan yang mengukur perubahan energi panas ketika satu mol suatu senyawa terbentuk dari unsur-unsurnya dalam keadaan standar. Contohnya, reaksi pembentukan air yang memiliki nilai energi sebagai berikut:
H2(g) + 1/2O2(g) → H2O(l)
ΔHf = -285.8 kJ/mol
3. Entalpi Penguraian (ΔHd)
Sementara ΔHd adalah perubahan energi panas ketika satu mol suatu senyawa diuraikan menjadi unsur-unsurnya dalam keadaan standar. Misalnya pada proses penguraian air yang memiliki nilai energi sebagai berikut:
H2O(l) → H2(g) + 1/2O2(g)
ΔHd = 285.8 kJ/mol
Kemudian juga pada proses penguraian besi(III) oksida menjadi besi yang memiliki nilai energi:
2Fe2O3(s) + 3C(s) → 4Fe(s) + 3CO2(g)
ΔHd = +823 kJ/mol
4. Entalpi Pembakaran (ΔHc)

Kemudian, ΔHc mengukur perubahan energi panas ketika satu mol senyawa terbakar sempurna dalam oksigen, lalu menghasilkan produk akhir yang paling stabil. Sebut saja pada pembakaran glukosa memiliki nilai energi:
C6H12O6(s) + 6O2(g) → 6CO2(g) + 6H2O(l)
ΔHc = -2803 kJ/mol
Kemudian pada pembakaran metana memiliki nilai energi:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)
ΔHc = -890.3 kJ/mol
5. Entalpi Penetralan (ΔHn)
Sementara itu, ΔHn penetralan mengukur perubahan energi panas dalam rekasi netralisasi, yaitu ketika asam dan basa bereaksi untuk membentuk air dan garam. Contohnya pada reaksi antara asam klorida dan natrium hidroksida, nilai energi yang dihasilkan adalah:
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
ΔHn = -57.3 kJ/mol
Selain itu, proses penetralan antara asam sulfat dan natrium hidroksida memiliki nilai energi sebagai berikut:
H2SO4(aq) + 2NaOH(aq) → Na2SO4(aq) + 2H2O(l)
ΔHn = -98.2 kJ/mol
6. Entalpi Peleburan (ΔHfus)
Selanjutnya, ΔHfus mengukur perubahan energi panas ketika satu mol zat padat melebur menjadi cair dalam suhu lebur yang konstan. Contohnya pada peleburan es menjadi air yang memiliki nilai energi sebesar:
H2O(s) → H2O(l)
ΔHfus = 6.01 kJ/mol
7. Entalpi Penguapan (ΔHvap)
Jenis terakhir adalah ΔHvap yang mengukur perubahan energi panas ketika satu mol zat cair menguap menjadi gas dalam suhu penguapan yang konstan. Misalnya pada peristiwa penguapan air, energi yang dihasilkan adalah
H2O(l) → H2O(g)
ΔHvap = 40.79 kJ/mol
Cara Menghitung Entalpi

Cara hitung energi dalam hukum termodinamika ini biasanya melibatkan perbedaan energi awal (sebelum proses) dengan energi akhir (setelah proses). Berikut bawah ini adalah cara umum dalam menghitungnya:
- Pertama, tentukan jenis energi yang ingin dihitung.
- Lalu, tentukan reaksi atau proses kimianya, tuliskan juga produk dan reaktan dalam persamaan reaksinya dan pastikan koefisien stoikiometri yang sesuai.
- Kemudian, tentukan nilai H setiap komponen menggunakan tabel standar.
- Selanjutnya, hitung nilai-nilai tersebut untuk mendapatkan ΔH.
- Terakhir, tentukan tanda ΔH. Jika hasil pengurangan positif, maka reaksi atau pembentukan akan bersifat endotermik (absorbsi panas). Jika hasil pengurangan negatif, maka reaksi atau pembentukan akan bersifat eksotermik (melepaskan panas).
Contoh Soal dan Pembahasan Terkait Entalpi
Selanjutnya, simak 3 soal di bawah ini untuk menguji pemahaman Anda:
1. Contoh Soal 1
Hitunglah ΔH untuk reaksi berikut:
2CO(g) + O2(g) → 2CO2(g)
Dengan data berikut:
ΔHf CO2 = -393.5 kJ/mol
ΔHf CO = -110.5 kJ/mol
Pembahasan:
ΔH reaksi dapat dihitung dengan mengurangkan H pembentukan produk dari reaktan. Selanjutnya gunakan data ΔHf CO2 dan ΔHf CO:
ΔHr = Σ(nΔHf produk) – Σ(mΔHf reaktan)
ΔHr = (2 mol × -393.5 kJ/mol) – (2 mol × -110.5 kJ/mol) – (1 mol × 0 kJ/mol) = -787 kJ/mol
Jadi, ΔH untuk reaksi tersebut adalah -787 kJ/mol.
2. Contoh Soal 2
Berapa perubahan entalpi pembakaran (ΔHc) glukosa (C6H12O6) dalam reaksi berikut?
C6H12O6(s) + 6O2(g) → 6CO2(g) + 6H2O(l)
Diketahui bahwa ΔHf CO2 = -393.5 kJ/mol, ΔHf H2O = -285.8 kJ/mol, dan ΔHf C6H12O6 = -1273 kJ/mol
Pembahasan:
ΔH pembakaran glukosa (ΔHc glukosa) adalah ΔH ketika satu mol glukosa terbakar sempurna dalam oksigen menghasilkan produk akhir CO2 dan H2O. Kemudian, gunakan data ΔHf CO2, ΔHf H2O, dan ΔHf C6H12O6 di atas:
ΔHc = Σ(nΔHf produk) – Σ(mΔHf reaktan)
ΔHc = ((6 mol × ΔHf CO2) + (6 mol × ΔHf H2O)) – (1 mol × ΔHf C6H12O6)
Lalu, substitusi nilai, sehingga:
ΔHc = ((6 mol × -393.5 kJ/mol) + (6 mol × -285.8 kJ/mol)) – (1 mol × (-1273 kJ/mol))
ΔHc = (-2361 kJ/mol + (-1714.8 kJ/mol)) + 1273 kJ/mol = -1802.8 kJ/mol
Jadi, perubahan ΔHc glukosa (C6H12O6) adalah -1802.8 kJ/mol.
3. Contoh Soal 3
Hitunglah ΔH penetralan (ΔHn) untuk reaksi berikut:
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
Diketahui bahwa ΔHf HCl = -92.3 kJ/mol, ΔHf NaOH = -469 kJ/mol, ΔHf NaCl = -411.2 kJ/mol, sedangkan ΔHf H2O = -285.8 kJ/mol
Pembahasan:
ΔH penetralan (ΔHn) tersebut terjadi ketika asam (HCl) dan basa (NaOH) bereaksi membentuk garam (NaCl) dan air (H2O). Gunakan data ΔHf HCl, ΔHf NaOH, ΔHf NaCl, dan ΔHf H2O yang ada:
ΔHn = Σ(nΔHf produk) – Σ(mΔHf reaktan)
ΔHn = (1 mol × ΔHf NaCl) + (1 mol × ΔHf H2O) – (1 mol × ΔHf HCl) – (1 mol × ΔHf NaOH)
Substitusikan nilai, sehingga:
ΔHn = -411.2 kJ/mol + -285.8 kJ/mol – (-92.3 kJ/mol) – (-469 kJ/mol)
ΔHn = -15.9 kJ/mol
Jadi, ΔHn untuk reaksi tersebut adalah -15.9 kJ/mol.
Sudah Bisa Menghitung Entalpi Suatu Reaksi?
Kesimpulannya, entalpi merupakan konsep penting dalam kimia yang memahami perubahan energi panas dalam reaksi kimia dan perubahan fasa. Jika Anda ingin menguasai materi ini, maka Anda perlu banyak latihan soal untuk mengasah kemampuan.Terutama ketika Anda akan menentukan jenis entalpi yang perlu Anda gunakan untuk menghitung ΔH pada soal. Tak ada salahnya juga untuk menghafal beberapa nilai ΔH yang umum. Sehingga, ketika Anda mencari nilai energi, tekanan panas, dan volume suatu zat kimia, maka hasilnya akan lebih akurat.

