Hidrolisis adalah reaksi penguraian molekul air (H2O) menjadi kation H+ dan anionnya OH– melalui proses kimiawi. Rekasi tersebut berkaitan dengan pembentukan larutan garam. Mengapa demikian? Apa hubungannya dengan garam? Yuk perhatikan ulasannya dalam artikel ini!
Apa itu Hidrolisis?
Istilah hidrolisis berasal dari bahasa Yunani Kuno, ‘hidro’ berarti ‘air’ sedangkan ‘lisis’ artinya penguraian. Secara sederhana, artinya adalah reaksi pemecahan senyawa atau ikatan kimia dengan bantuan molekul air. Selain itu, konsep reaksi tersebut berkaitan dengan sifat garam dalam air.
Proses pembentukan garam biasa disebut reaksi netralisasi, yaitu reaksi yang terjadi antara asam dan basa sehingga membentuk garam. Berbeda dengan hidrolisis, reaksi antara senyawa garam dengan air membentuk ion positif dan negatif. Ion-ion tersebut nantinya bereaksi dengan air dan membentuk asam atau basa.
Menurut definisi biologi dari laman Libretexts, hidrolisis adalah reaksi pemecahan suatu polimer menjadi monomer dengan melibatkan molekul air dan katalis. Molekul air inilah yang berperan dalam pemecahan senyawa polimer. Dia akan membentuk air saat terjadi sintesis senyawa polimer dari monomernya.
Ada Berapakah Jenis Reaksi Hidrolisis?
Secara umum, terdapat 3 jenis reaksi, yaitu hidrolisis asam, basa, dan garam. Namun, pada penerapan kimia, reaksi yang paling banyak digunakan adalah hidrolisis garam. Berikut ini adalah penjelasan terkait masing-masing pemecahan senyawa kimia melalui penambahan air tersebut.
1. Hidrolisis Asam
Berdasarkan teori Bronsted Lowry, molekul air melepaskan proton, tetapi air dapat bersifat asam maupun basa. Hidrolisis asam merupakan penggunaan asam prostat sebagai katalis ikatan kimia melalui reaksi substitusi nukleofilik. Biasanya, sebagian besar menggunakan senyawa asam fosfat atau asam sulfat pekat.
2. Hidrolisis Basa
Contoh reaksi pemecahan ikatan kimia dengan penambahan air pada basa ama adalah natrium asetat terdisosiasi menjadi kation (Na+) dan anionnya (COOH–). Ion natrium cenderung tetap dalam membentuk ionik Na+, sedangkan ion asetat akan bereaksi dengan ion hidronium dan membentuk asam asetat. Hasilnya, larutan akan bersifat basa akibat kelebihan ion hidronium.
3. Hidrolisis Garam
Pengertian hidrolisis garam adalah senyawa ionik yang terbentuk akibat reaksi penetralan antara senyawa asam maupun basa. Oleh karena itu, dia memiliki sifat yang berbeda-beda, tergantung dari penyusunnya. Berdasarkan pembentukannya, terdapat lebih dari 3 macam hidrolisis garam yang dapat kamu pelajari berikut ini.
a) Garam Total (Asam kuat dan Basa kuat)
Larutan garam yang terbentuk dari asam kuat dan basa kuat tidak terhidrolisis karena sifatnya netral. Asam kuat merupakan senyawa yang memiliki pH di bawah 3 dan dapat terionisasi sempurna dengan air.
Begitu juga dengan basa, basa kuat merupakan senyawa yang memiliki pH di atas 7. Ketika basa kuat larut dalam air, maka ia akan melepaskan ion OH–.
Contoh garam yang terbentuk dari asam kuat dan basa kuat adalah NaCl. Ketika bereaksi dengan air, ia akan melepaskan kation (Na+) dari NaOH, dan anion (Cl–) dari HCl. Keduanya akan terionisasi sempurna dalam air, berikut persamaan reaksinya
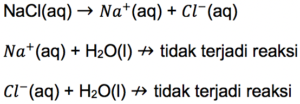
b) Garam parsial (Asam Lemah dan Basa Kuat)
Asam lemah merupakan senyawa asam dengan tingkat keasaman (pH) di bawah 7 dan di atas 3. Larutan yang terbuat dari asam lemah tidak mengalami ionisasi sempurna dalam air karena jumlah ion hidrogen yang dilepas dalam air relatif sedikit.
Contoh dari senyawa asam lemah antara lain, asam asetat (CH3COOH), asam oksalat (C2H2O4), asam karbonat (H2CO3) dan lainnya. Sedangkan garam parsial yang terbuat dari asam lemah dan basa kuat adalah natrium asetat (NaCH3COO). Ilustrasi untuk persamaan reaksinya seperti di bawah ini:
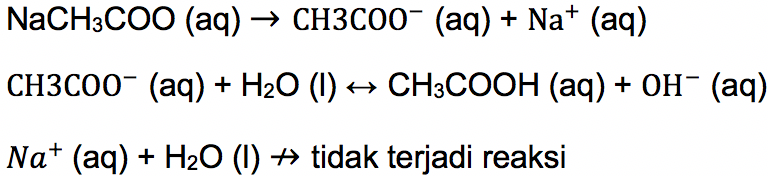
Reaksi penguraian garam oleh air namun hanya sebagian saja yang terhidrolisis merupakan pengertian hidrolisis parsial. Seperti persamaan reaksi di atas, natrium asetat terdiri dari anion COOH– dan kation Na+. Kation tersebut berasal dari basa kuat (NaOH) sehingga dia tidak terhidrolisis.
Sementara, ion COOH– berasal dari asam lemah (CH3COOH). Ion asetat itulah yang akan bereaksi dengan air. Reaksi itu disebut dengan hidrolisis anion yang bersifat basa.
c) Garam Parsial (Asam Kuat dan Basa Lemah)
Sama hal nya dengan asam lemah dan basa kuat, reaksi ini terjadi secara parsial. Basa lemah merupakan senyawa yang memiliki pH di atas 7, contohnya adalah amonia (NH3), natrium bikarbonat (NaHCO3), ammonium hidroksida (NH4OH), dan lainnya.
Contoh senyawa garam yang terbentuk dari asam kuat dan basa lemah adalah amonium klorida (NH4Cl). Garam amonium klorida terbentuk dari amonia (basa lemah) dengan HCl (asam kuat), maka kation dari amonia lah yang akan bereaksi dengan air. Gambaran persamaannya adalah:
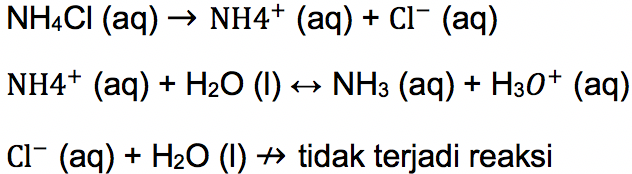
Berdasarkan penjelasan sebelumnya, kation dari asam kuat tidak terhidrolisis sehingga yang bisa bereaksi dengan air adalah kation dari basa lemah. Jadi, reaksi ini disebut hidrolisis kation.
Menurut teori Arrhenius, asam merupakan senyawa yang melepaskan ion H3O+ dalam air. Pada persamaan reaksi ii (baris kedua pada gambar di atas), terlihat adanya hasil produk H3O+, artinya reaksi tersebut bersifat asam.
d) Garam Total (Asam Lemah dan Basa Lemah)
Berbeda dengan kedua teori sebelumnya, pembentukan garam yang tersusun dari asam lemah dan basa lemah akan terjadi hidrolisis total. Lalu, apa pengertian hidrolisis total? Ternyata, dia merupakan suatu senyawa kation dan anion yang bereaksi dengan air secara sempurna. Bagaimana sifat larutannya?
Sifat larutan garam jika terjadi hidrolisis total tergantung pada kekuatan asam lemah dan basa lemahnya. Jika kekuatan asam lemah lebih kecil dari basa lemah (ka<kb), maka anion akan terhidrolisis lebih banyak sehingga larutan bersifat basa.
Demikiab pula sebaliknya, jika kekuatan asam lemah lebih besar dari basa lemah (ka>kb) maka kationnya yang akan terhidrolisis lebih banyak sehingga larutan bersifat asam.
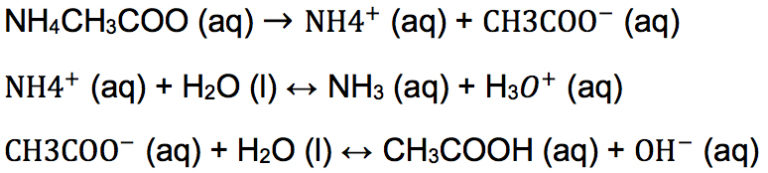
Agar Lebih Paham, Cermati Contoh Soal Berikut!
1. Tentukan dari 5 ion dibawah ini yang mengalami hidrolisis dan tidak!
CN–; Na+; CO32-; S2-
Penyelesaian:
- CN–; CO32-; S2- = Terhidrolisis dalam air.
- Na = Tidak mengalami hidrolisis dalam air.
2. Tentukan sifat keasaman dan sifat hidrolisis garam dari keempat senyawa berikut ini:
- NaCH3OO
- NH4Br
- CaSO4
- NH4CN
Penyelesaian:
- NaCH3OO = suatu senyawa garam yang terbentuk dari NaOH (basa kuat) dengan CH3COOH (asam lemah) sehingga memiliki sifat hidrolisis parsial dan memiliki pH lebih dari 7 atau bersifat basa.
- NH4Br = sama dengan sebelumnya, NH4Br terbentuk dari asam kuat (HBr) dengan basa lemah (NH4) yang memiliki sifat hidrolisis sebagian. Namun, NH4Br memiliki sifat asam atau pH di bawah 7.
- CaSO4 = Senyawa ini terbentuk dari asam kuat (H2SO4) dengan basa kuat (CaSO4), maka tidak terjadi reaksi hidrolisis dan sifatnya netral.
- NH4CN = Senyawa garam yang berasal dari asam lemah (HCN) dengan basa lemah (NH4OH) sehingga terjadi hidrolisis total dan pH nya dapat dihitung jika diketahui ka dan kb nya.
Apakah Reaksi Hidrolisis Berperan dalam Kehidupan Sehari-hari?
Berdasarkan penjelasan tentang pengertian hidrolisis, kamu dapat melihat salah satu contohnya dalam proses pencernaan manusia. Molekul air (H2O) memiliki peran dalam memecah senyawa menjadi lebih sederhana sehingga tubuh lebih mudah mencerna makanan.
Reaksi ini juga dapat kamu amati dalam penggunaan garam pada masakan. Ketika kamu menambahkannya, masakan akan memiliki rasa asin yang merupakan salah satu unsur penyedap rasa alami.
Melalui berbagai peristiwa tersebut, kamu dapat menyimpulkan bahwa peristiwa pemecahan ikatan kimia melalui penambahan air ini erat berkaitan dengan kehidupan sehari-hari. Faktanya, kejadian tersebut tidak dapat dipisahkan dari kehidupan manusia secara umum.