Hukum Boyle berperan penting dalam memahami bagaimana gas berperilaku dalam berbagai kondisi dan memiliki aplikasi luas dalam berbagai disiplin ilmu. Ingin tahu lebih dalam tentang hukum tersebut? Gali selengkapnya di sini!
Definisi Hukum Boyle
Hukum Boyle atau Hukum Mariotte adalah hukum gas ideal yang menetapkan hubungan antara tekanan dan volume pada suhu konstan. Dengan kata lain, bunyi dari hukum ini adalah bahwa tekanan absolut gas ideal berbanding terbalik dengan volumenya dalam kondisi massa dan suhu yang konstan.
Prinsip Boyle (suhu konstan) adalah salah satu dari tiga prinsip khusus hukum gas ideal. Dua lainnya adalah Hukum Charles (tekanan konstan) dan Hukum Gay-Lussac (volume konstan). Keduanya merupakan hukum lain yang masih berkaitan adalah hukum Avogadro (hubungan volume dengan jumlah partikel).
Sejarah dan Tokoh yang Berperan Hukum Boyle
Untuk memahami konsep hukum yang juga dikenal sebagai hukum gas ideal ini, penting untuk mengetahui konteks sejarah di mana hukum ini bermula.
Nama hukum tersebut diambil dari nama ahli kimia dan fisikawan, yaitu Robert Boyle. Prosesnya berawal dari penemuan Richard Towneley dan Henry Power yang sudah lebih dulu menggambarkan hubungan antara tekanan dan volume gas.
Sementara itu, Robert Boyle merupakan seorang ilmuwan, filsuf alam, dan teolog asal Irlandia. Beliau terkenal sebagai salah satu pendiri ilmu kimia modern dan pionir eksperimen ilmu alam.
Robert Boyle secara eksperimental mengkonfirmasi hasil temuan Towneley dan Power menggunakan perangkat yang dibangun oleh asistennya, yaitu Robert Hooke.
Peralatannya terdiri dari tabung berbentuk huruf “J” tertutup. Boyle menuangkan merkuri ke dalam tabung, mengurangi volume udara dan meningkatkan tekanannya. Dia menggunakan jumlah merkuri yang berbeda, merekam tekanan udara dan pengukuran volume, dan membuat grafik data.
Boyle menerbitkan hasil percobannya pada tahun 1662 dalam karyanya yang terkenal, “New Experiments Physico-Mechanical, Touching the Spring of Air“.
Di dalam karya ini, Boyle menjelaskan bahwa eksperimennya melibatkan pengukuran tekanan gas pada volume yang berbeda. Itulah asal muasal hukum gas ideal yang beliau temukan.
Hukum tersebut juga dikenal sebagai hukum Mariotte karena fisikawan Prancis Edme Mariotte secara independen menemukan hukum yang sama pada tahun 1670. Kontribusi antara Boyle dan Mariotte kemudian secara umum disebut dengan istilah hukum Boyle-Mariotte.
Prinsip Hukum Boyle
Prinsip Boyle berdasarkan pada prinsip dasar bahwa partikel-partikel gas mengisi volume yang tersedia dan berinteraksi satu sama lain dalam cara tertentu. Namun, dalam kasus gas ideal, partikel-partikel ini anggap sebagai titik-titik yang tidak memiliki volume dan tidak saling berinteraksi.
Oleh karena itu, perubahan volume gas akan mengubah frekuensi tabrakan antarpartikel gas dengan dinding wadah, yang akhirnya dapat mempengaruhi tekanan gas.
Prinsip-prinsip yang mendasari hukum Boyle secara ringkas adalah ketika volume gas diperbesar, partikel gas memiliki lebih banyak ruang untuk bergerak, sehingga jumlah tabrakan antar partikel per satuan waktu berkurang. Fakta tersebut mengakibatkan penurunan tekanan gas.
Sebaliknya, ketika volume gas diperkecil, ruang untuk pergerakan partikel gas menjadi lebih sempit, sehingga jumlah tabrakan antarpartikel per satuan waktu meningkat. Kondisi itu mengakibatkan peningkatan tekanan gas.
Dalam konteks tersebut, hukum gas ideal menerangkan dengan jelas tentang hubungan antara tekanan dan volume gas, serta menggambarkan mengapa tekanan dan volume berbanding terbalik dalam gas ideal.
Asumsi-asumsi yang memenuhi konsep hukum gas ideal adalah sebagai berikut:
- terdiri dari sejumlah besar partikel dan tidak ada gaya tarik antara partikel,
- setiap partikel gas akan selalu bergerak secara acak,
- ukuran partikel dapat terabaikan sesuai dengan ukuran wadah,
- setiap tumbukan yang terjadi sangat elastis,
- partikel gas terdistribusikan secara merata ke seluruh ruang dalam wadah, dan
- gerak partikel gas akan mematuhi hukum gerak Newton.
Apa saja Rumus-Rumus Hukum Boyle?
Hubungan antara volume dan tekanan suatu gas pada massa dan suhu konstan, dapat tertulis secara matematis sebagai berikut.
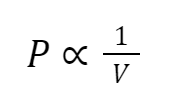
Di mana (P) adalah tekanan yang diberikan oleh gas dan (V) adalah volume yang menempati suatu wadah. Persamaan dapat diubah dengan menambahkan konstanta, k sebagai proporsionalitas rumus.

Misalnya gas ideal berada pada tekanan (P₁) dan volume (V₁). Kemudian, gas mengalami ekspansi atau kontraksi dengan suhu dan jumlah gas tetap konstan. Setelah perubahan, tekanan dan volume gas baru adalah (P₂) dan (V₂).
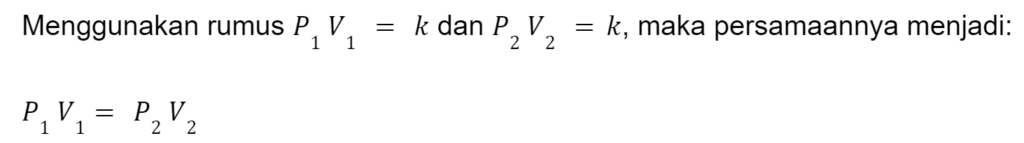
Persamaan tersebut dapat berguna untuk memprediksi peningkatan tekanan yang diberikan oleh gas pada dinding wadahnya ketika volume wadahnya menurun, dengan kuantitas serta suhu absolutnya tetap tidak berubah.
Contoh Soal Terkait Hukum Boyle dan Pembahasannya
Berikut ini adalah beberapa contoh soal yang menerapkan aturan Boyle
Contoh Soal 1
Sebuah balon memiliki volume awal 10 liter dan tekanan awal 1 atm. Jika tekanan balon meningkat menjadi 2 atm, berapa volume balonnya (suhu dan jumlah gas tetap)?
Pembahasan
Diketahui:
P1=1 atm (tekanan awal)
V1=10 liter (volume awal)
P2=2 atm (tekanan akhir)
Dengan menggunakan rumus gas ideal Boyle, maka perhitungan untuk mencari volume akhirnya adalah
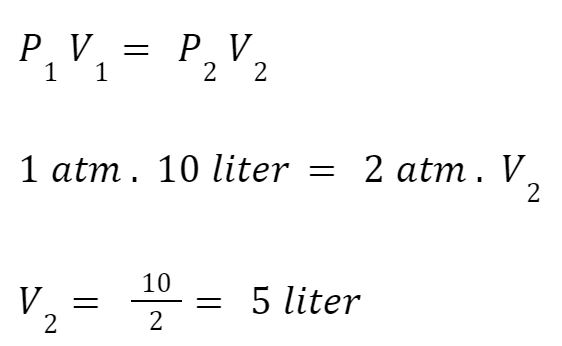
Jadi, volume balon adalah 5 liter setelah tekanannya meningkat menjadi 2 atm.
Contoh Soal 2
Gas ideal tentu pasti memiliki tekanan sebagai P dan volume sebagai V. Kemudian, tekanan gas naik dan berubah menjadi 2 kali tekanan awal. Berapa volume gas saat ini?
Pembahasan
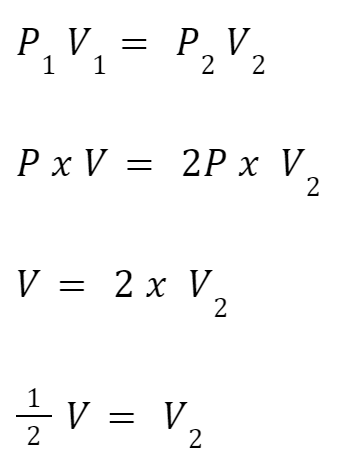

Penerapan Hukum Boyle dalam Kehidupan Manusia
Keberadaan hukum gas ideal tentu memberikan banyak manfaat bagi kehidupan manusia sehari-hari. Bahkan secara tidak langsung, justru mempengaruhi sistem pernapasan makhluk hidup. Apa saja penerapan prinsip Boyle lainnya dalam kehidupan?
1. Sistem Pernapasan Makhluk Hidup
Selama proses respirasi pada sistem pernapasan manusia, paru-paru menerapkan prinsip kerja Boyle. Ketika menghirup udara, paru-paru tentu akan terisi dengan udara, oleh karena itu paru-paru akan mengembang.
Volume paru-paru akan meningkat ketika tekanan menurun. Begitu juga ketika paru-paru mengeluarkan udara, paru-paru akan mengecil sehingga volumenya berkurang dan tekanannya meningkat. Perubahan tekanan dan volume di paru-paru hanya bersifat sementara dan periodik .
2. Botol Soda
Saat botol terbuka, akan terdengar suara mendesis dan beberapa molekul udara keluar. Keadaan tersebut akan memberikan ruang bagi pergerakan molekul udara. Di sinilah perubahan tekanan terjadi seiring dengan perubahan volume.
Biasanya, ketika Anda mengocok botol soda, setelah membuka tutupnya, soda akan mengembang dan bahkan, tumpah ke tangan. Kejadian tersebut terjadi karena gas dalam botol berusaha keluar dan tercampur ke dalam cairan, sehingga ketika gas keluar akan mengeluarkan cairan berbusa.
3. Penggunaan Jarum Suntik
Jarum suntik yang berguna sebagai peralatan medis, juga menggunakan prinsip kerja hukum Boyle. Dalam jarum suntik terdapat silinder yang berfungsi untuk mengumpulkan cairan dan pendorong untuk memvariasikan tekanan.
Ketika suntikan tertekan, volume fluida berkurang sehingga tekanan akan meningkat. Begitu juga Anda ketika menarik suntikan, volumenya meningkat sementara tekanannya berkurang.
4. Cat Semprot
Biasanya, sebelum menyemprotkan cat semprot, Anda harus mengocok agar zat di dalam kaleng dapat menyebar. Ada dua zat dalam kaleng cat semprot, yaitu produk cat itu sendiri dan gas yang saling bertekanan dalam bentuk cairan.
Gas cair memiliki titik didih jauh di bawah suhu kamar. Oleh sebab itu, kaleng cat semprot perlu tertutup rapat, agar gas tidak mendidih. Setelah menekan cat semprot, maka gas akan menekan cat di dalam kaleng. Di bawah tekanan tinggi, cat akan “terpaksa” keluar dari kaleng.
Apa Pentingnya Memahami Hukum Boyle?
Hukum gas ideal menjelaskan hubungan antara tekanan volume gas dan jumlah gas yang tetap. Dengan demikian, konsep Hukum Boyle tersebut memungkinkan Anda melakukan perhitungan yang berhubungan dengan perubahan tekanan dan volume gas dalam berbagai situasi.

