Salah satu konsep penting dalam bidang ilmu kimia yang berguna untuk menghitung perubahan entalpi (ΔH) dalam reaksi kimia adalah Hess Law atau hukum Hess. Tentu perannya menjadi kunci untuk memahami dan menghitung energi yang tidak dapat diukur secara langsung. Yuk ,pahami lebih dalam konsep kimia yang menarik ini, di sini!
Apa Itu Hukum Hess?
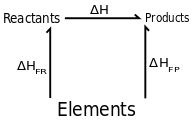
Reaksi kimia dapat menggunakan berbagai rute yang berbeda. Katakanlah Anda memulai reaksi dengan reaktan A dan ingin sampai ke produk B. Anda bisa langsung bergerak dari A ke B, atau Anda bisa mundur sepanjang alfabet, melewati Z, X, Y, sampai Anda mencapai B.
Menurut konsep hukum kimia yang satu ini, tidak masalah berapa banyak langkah yang Anda gunakan, asalkan Anda memulai dan mengakhiri dengan kondisi yang sama, perubahan entalpi akan sama. Bunyi hukumnya adalah “Entalpi reaksi tidak tergantung pada jalannya reaksi, tetapi pada hasil akhir reaksi”.
Hukum Hess ada hubungannya dengan entalpi nett suatu reaksi. Secara keseluruhan, perubahan entalpi total reaksi adalah jumlah dari semua perubahan, tidak peduli jumlah langkah atau tahapan dalam reaksi.
Bunyi hukum ini sesuai dengan prinsip hukum kekekalan energi, dan hukum pertama termodinamika, yang mengatakan bahwa energi selalu ada dalam reaksi kimia.
Energi tersebut tidak dapat dibentuk atau dimusnahkan, tetapi dapat berubah dari suatu bentuk menjadi bentuk lain. Oleh karena itu, entalpi menjadi fungsi fundamental.
Ada beberapa persyaratan yang harus diikuti oleh reaksi untuk menggunakan Hess Law. Misalnya, jika ada beberapa langkah untuk reaksi, setiap persamaan harus seimbang dengan benar. Di samping itu, semua langkah reaksi harus mulai dan berakhir pada suhu dan tekanan konstan untuk menjaga kondisi reaksi tetap teratur.

Persamaan di atas memungkinkan reaksi yang mengandung reaktan dan produk diperlakukan sebagai persamaan aljabar dan terdapat operasi matematika. Harus Anda ingat, bahwa reaksi eksotermik berjalan dalam satu arah dan akan menjadi reaksi endotermik dalam arah sebaliknya.
Siapa Tokoh Penemu Hukum Hess?
Germain Henri Hess adalah seorang ahli kimia asal Rusia yang terkenal sebagai bapak penemu hukum kimia ini. Beliau lahir pada tahun 1802 di Swiss dan meninggal pada tahun 1850 di St. Petersburg, Rusia. Hess adalah seorang ahli kimia yang brilian dan menghabiskan sebagian besar hidupnya untuk penelitian kimia fisika.
Pada tahun 1840, ia mempublikasikan makalah yang menggambarkan konsep aturan Hess, yang kemudian menjadi konsep penting dalam kimia fisika. Hess juga dikenal karena penelitiannya tentang perpindahan panas dalam reaksi kimia dan perannya dalam hubungan antara perubahan entalpi dan perubahan energi internal sistem kimia.
Lalu, Apa Pentingnya Hukum Hess?
Setiap zat baik atom atau molekul memiliki energi di dalamnya. Energi internal tergantung pada sifat gaya dan suhu yang ada dalam zat.
Ketika zat mengalami reaksi kimia, beberapa ikatan yang menghubungkan beberapa atom rusak dan beberapa ikatan kimia dibuat baru. Pemutusan dan pembuatan ikatan melibatkan energi.
Jadi, dalam reaksi kimia, zat produk mungkin memiliki energi yang lebih sedikit atau sama, atau bahkan lebih banyak daripada zat yang bereaksi. Reaksi yang sesuai dapat melepaskan panas menjadi eksotermik atau menyerap panas menjadi endotermik. Reaktan dapat bereaksi lebih lanjut untuk menghasilkan produk:
- dalam satu langkah, atau
- melalui beberapa langkah, atau pun
- bersama dengan produk lainnya.
Perubahan energi panas dari reaksi yang terukur pada volume konstan adalah perubahan energi internal ΔE. Sedangkan, energi yang terukur pada tekanan konstan adalah perubahan entalpi ΔH.
Pengetahuan tentang perubahan energi dalam reaksi apa pun sangat penting untuk memanipulasi reaktan dan produk dalam proses kimia sesuai kebutuhan kita. Hess Law merupakan satu-satunya cara yang berguna untuk menghitung perubahan entalpi yang tidak dapat terukur dalam perubahan fisika dan kimia.
Persamaan Hukum Hess
Serupa dengan berbagai jenis hukum, aturan maupun konsep dalam kimia fisik lainnya, Hess Law juga memiliki ilustrasi persamaannya.
ΔH total = ΣΔH produk – ΣΔH reaktan
Keterangan:
- ΣΔH produk adalah total perubahan entalpi produk dalam reaksi.
- ΣΔH reaktan adalah total perubahan entalpi reaktan dalam reaksi.
- ΔH total adalah perubahan entalpi total reaksi.
Seperti halnya entalpi, hukum ini juga dapat berguna untuk menentukan fungsi keadaan lainnya, seperti energi bebas dan entropi.
Contohnya antara lain yaitu siklus termodinamika Bordwell yang memanfaatkan kesetimbangan yang mudah terukur dan potensi redoks untuk menentukan nilai energi bebas Gibbs, dengan rumus:
ΔG total = ΣΔG produk – ΣΔG reaktan
Sementara, rumus entropiny adalah sebagai berikut:
ΔS total = ΣΔS produk – ΣΔS reaktan
Penerapan Hukum Hess
Selain menghitung entalpi reaksi untuk pengukuran energi yang tidak dapat terhitung secara langsung, hukum ini berguna dalam beragam penerapan lain.
- Menentukan afinitas elektron berdasarkan energi kisi teoritis.
- Menghitung perubahan panas berdasarkan transisi fasa.
- Menghitung perubahan panas ketika suatu zat mengubah alotrop atau modifikasi struktural yang berbeda-beda dari sebuah unsur.
- Menemukan panas pembentukan zat antara zat tidak stabil dalam suatu reaksi.
- Menentukan energi kisi senyawa ionik.
Contoh Soal Terkait Hukum Hess dan Pembahasannya
Berikut ini adalah beberapa contoh soal yang menerapkan aturan Hess:
Soal 1
Hitung perubahan entalpi standar untuk reaksi
CO₂ (g) + H₂ (g) → CO (g) + H₂O (g)
Mengingat bahwa ΔH untuk senyawa CO₂ (g), CO (g) dan H₂O (g) masing-masing sebesar -393,5 kJ/mol, -110,5 kJ/mol, dan 241,8 kJ/mol.
Pembahasan
Lantaran senyawa CO dan H₂O posisinya berada pada ruas kanan sebagai produk, maka nilai ΔH dikalikan dengan -1. Dengan demikian, masing-masing menjadi 110,5 kJ/mol, dan -241,8 kJ/mol. Sedangkan nilai ΔH untuk unsur H₂ bernilai sama dengan 0.
Berdasarkan rumus pada pemaparan sebelumnya, maka nilai perubahan entalpi reaksi adalah:
ΔH total = ΣΔH produk – ΣΔH reaktan
= [ – 241,8 – 110,5 ] – [ – 393,5 + 0 ]
= – 352,3 + 393,5 = + 41,2 kJ/mol
Maka, nilai perubahan entalpi standarnya adalah + 41,2 kJ/mol
Soal 2
Berapa nilai ΔH untuk reaksi berikut?
CS₂ (l) + 3 O₂ (g) → CO₂ (g) + 2 SO₂ (g)
Dengan data entalpi pembentukan reaksi (ΔHf) sebagai berikut:
C (s) + O₂ (g) → CO₂ (g); ΔHf = -393,5 kJ/mol … (persamaan 1)
S (s) + O₂ (g) → SO₂ (g); ΔHf = -296,8 kJ/mol … (persamaan 2)
C (s) + 2 S (s) → CS₂ (l); ΔHf = 87,9 kJ/mol … (persamaan 3)
Pembahasan
Ada beberapa aturan yang harus Anda ikuti ketika memanipulasi reaksi di bawah ini.
- Reaksinya bisa dibalik sehingga akan mengubah tanda ΔHf.
- Reaksi dapat dikalikan dengan konstanta. Pengkalian nilai ΔHf harus sama dengan pengkalian konstantanya.
- Setiap kombinasi dari dua aturan dapat digunakan.
Untuk mendapatkan CO₂ pada sisi produk, maka dapat menggunakan persamaan 1. C (s) + O₂ (g) → CO₂ (g); ΔHf = -393,5 kJ/mol … (persamaan 1)
Kemudian, untuk senyawa O₂ Anda masih memerlukan O₂ sebanyak 2 lagi, sehingga persamaan 2 dapat Anda kalikan dengan dua. Ingatlah untuk mengkalikan nilai ΔHf dengan 2 juga. Oleh karena itu persamaan 2 menjadi:
2 S (s) + 2 O₂ (g) → 2 SO₂ (g); ΔHf = 2(-296,8) kJ/mol … (persamaan 2)
Sekarang Anda memiliki dua S tambahan dan satu molekul C tambahan pada sisi reaktan yang tidak Anda butuhkan. Persamaan 3 juga memiliki dua S dan satu C pada sisi reaktan. Balikkan persamaan 3 ini untuk membawa molekul ke sisi produk. Ingatlah untuk mengubah tanda pada ΔHf.
CS₂ (l) → C (s) + 2 S (s) ; ΔHf = – 87,9 kJ/mol … (persamaan 3)
Ketika ketiga reaksi yang telah dimanipulasi dapat Anda tambahkan, dua sulfur tambahan dan satu atom karbon dapat Anda hapus, sehingga menyisakan reaksi yang Anda inginkan. Jumlahkan reaksi yang tersisa dengan nilai ΔHf untuk mendapatkan nilai ΔH total.
C (s) + O₂ (g) → CO₂ (g) ; ΔHf = -393,5 kJ/mol … (persamaan 1)
2 S (s) + 2 O₂ (g) → 2 SO₂ (g) ; ΔHf = 2(-296,8) kJ/mol … (persamaan 2)
CS₂ (l) → C (s) + 2 S (s) ; ΔHf = – 87,9 kJ/mol … (persamaan 3)
———————————————————————————————————— +
CS₂ (l) + 3 O₂ (g) → CO₂ (g) + 2 SO₂ (g) ;
ΔH total = -393,5 kJ/mol + 2(-296,8) kJ/mol + – 87,9 kJ/mol
= -393,5 kJ/mol – 593,6 kJ/mol + – 87,9 kJ/mol
= – 1075 kJ/mol
Sudah Paham Tentang Hukum Hess?
Dalam kesimpulannya, Hukum Hess memainkan peran penting dalam menghitung perubahan entalpi dalam reaksi kimia dengan menggabungkan reaksi-reaksi yang sudah ada. Bunyi dasarnya menyatakan bahwa perubahan entalpi dalam reaksi tidak tergantung pada rute reaksinya.
Ketika menerapkannya dengan benar, hukum ini memberikan wawasan yang berharga dalam kimia dan ilmu pengetahuan terkait, dan membantu Anda memahami serta menghitung perubahan energi dalam reaksi kimia yang kompleks.

