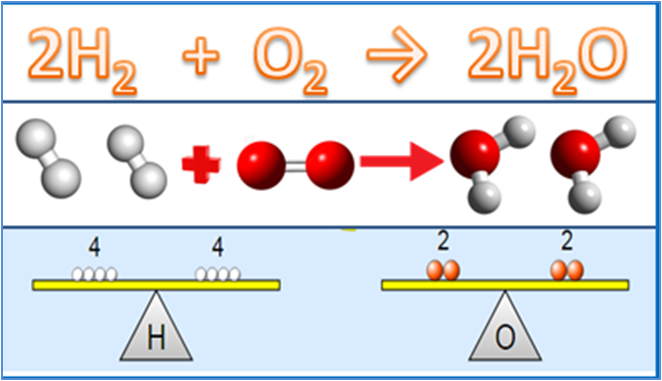
Dalam bidang ilmu kimia, persamaan reaksi kimia memiliki peran penting dalam memahami bagaimana zat-zat dapat bereaksi satu sama lain untuk membentuk zat baru. Sebab, persamaan ini menjadi representasi simbolis dari proses kimia di mana reaktan (zat-zat awal) berubah menjadi produk (zat-zat hasil).
Namun, apakah Anda tahu bagaimana cara menyetarakannya? Jika belum, simak artikel ini yang akan menjelaskan lengkap konsep persamaannya, pentingnya dalam ilmu kimia, serta cara membaca dan menafsirkan persamaannya.
Tentang Persamaan Reaksi Kimia
Persamaan reaksi kimia adalah cara penulisan yang menggambarkan perubahan zat-zat dalam suatu reaksi kimia. Ini melibatkan simbol-simbol kimia yang menunjukkan reaktan (zat-zat awal), produk (zat-zat hasil), fase reaksi, arah reaksi, dan jumlah zat.
Simbol (s) menunjukkan fasa reaksi solid atau zat padat, (l) berarti liquid atau zat cair, (aq) adalah aqueous atau zat berbentuk larutan dalam air, dan fasa gas bersimbolkan (g). Persamaan reaksi tidak hanya menggambarkan proses, tetapi juga mencerminkan Hukum Kekekalan Massa dan Hukum Perbandingan Tetap.
Hukum Kekekalan Massa menyatakan bahwa massa reaktan harus menyeimbangkan massa produk. Untuk menyeimbangkan persamaan kimia, atom-atom dari kedua unsur dan molekul pada sisi reaktan (sisi kiri) dan sisi produk (sisi kanan) harus sama satu sama lain.
Misalnya, persamaan reaksi sederhana untuk reaksi pembakaran metana (CH4) adalah:
CH4 + 2 O2 → CO2 + 2 H2O
Artinya, satu molekul metana dan dua molekul oksigen akan menghasilkan satu molekul karbon dioksida dan dua molekul air.
Koefisien dan Subskrip dalam Persamaan Reaksi Kimia
Secara teori, terdapat dua jenis angka yang muncul dalam persamaan reaksi kimia. Angka pertama adalah subskrip yang mana merupakan bagian dari rumus kimia reaktan dan produk. Selain itu, ada koefisien yang terletak di depan rumus untuk menunjukkan berapa banyak molekul zat yang digunakan atau diproduksi.
Kemudian, angka kedua adalah subskrip yang merupakan bagian dari rumus dan setelah rumus untuk reaktan dan produk ditentukan, sehingga subskrip bersifat tidak dapat berubah. Koefisien yang ada menunjukkan jumlah setiap zat yang terlibat dalam reaksi dan dapat berubah untuk menyeimbangkan persamaan.
Sebagai contoh, simak potongan persamaan di bawah ini:
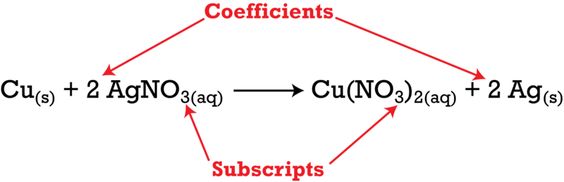
Persamaan di atas menunjukkan bahwa satu mol tembaga padat bereaksi dengan dua mol perak nitrat aqueous. Sehingga, menghasilkan satu mol larutan tembaga (II) nitrat dan dua atom perak padat.
Pentingnya Menyetarakan Persamaan Reaksi Kimia
Menyetarakan persamaan reaksi kimia adalah langkah penting dalam pemahaman dan analisis reaksi kimia karena melibatkan penyesuaian koefisien di depan simbol-simbol kimia. Berikut adalah beberapa alasan mengapa menyetarakan persamaan reaksi itu penting:
1. Hukum Kekekalan Massa
Hukum Kekekalan Massa menyatakan bahwa dalam suatu reaksi kimia, massa total reaktan harus sama dengan massa total produk. Dengan menyetarakan persamaan reaksi, pastikan bahwa atom-atom tidak diciptakan atau dihancurkan, dan massa total tetap konstan.
2. Konsistensi Atom
Dalam prinsip konsistensi atom, menyetarakan persamaan reaksi kimia memastikan bahwa jumlah atom dari setiap unsur di sebelah kiri persamaan sama dengan jumlah atom unsur yang sama di sebelah kanan. Oleh karena itu, hal ini penting karena tidak ada atom yang terbentuk atau hancur dalam reaksi kimia.
Langkah-Langkah Menyetarakan Persamaan Reaksi Kimia

Berdasarkan fungsi pentingnya di atas, berikut adalah langkah-langkah umum dalam menyetarakan persamaan reaksi kimia:
1. Tuliskan Persamaan Kimia yang Tidak Seimbang
Menulis persamaan kimia yang tidak seimbang adalah langkah pertama yang dapat Anda lakukan. Jika Anda perlu menyeimbangkan persamaan kimia dan hanya memiliki nama produk dan reaktan, maka Anda harus mencarinya atau menerapkan aturan penamaan senyawa untuk menentukan rumusnya terlebih dahulu.
Contohnya seperti fenomena karat besi di udara. Untuk menulis reaksinya, Anda perlu mengidentifikasi reaktan (besi dan oksigen) dan produk (karat). Selanjutnya, tulis persamaan reaksi kimia yang tidak seimbang menjadi:
Fe + O₂ → Fe₂O₃
Perhatikan bahwa reaktan selalu berada di sebelah sisi kiri panah dan tanda “+” memisahkan mereka. Selanjutnya, ada panah yang menunjukkan arah reaksi (reaktan menjadi produk). Produk selalu berada di sisi kanan panah.
2. Tuliskan Jumlah Atom
Langkah selanjutnya untuk menyeimbangkan persamaan kimia adalah menentukan berapa banyak atom dari setiap unsur yang ada di setiap sisi panah. Kita gunakan contoh reaksi kimia seperti berikut:
Fe + O₂ → Fe₂O₃
Untuk melakukan langkah ini, Anda perlu ingat bahwa subskrip menunjukkan jumlah atom. Misalnya, O₂ memiliki 2 atom oksigen.
Kemudian, Fe₂O₃ memiliki 2 atom besi dan 3 atom oksigen. Sedangkan Fe memiliki 1 atom. Ketika tidak ada subskrip, itu berarti hanya ada 1 atom. Lantas, bagaimana cara agar kita tahu persamaan reaksi kimia di atas belum seimbang?
Hukum Kekekalan Massa menyatakan massa tidak dibuat atau dihancurkan dalam reaksi kimia. Sehingga, Anda perlu menambahkan koefisien di depan rumus kimia untuk menyesuaikan jumlah atom agar di kedua sisi bernilai sama.
3. Tambahkan Koefisien untuk Menyeimbangkan Massa

Saat menyeimbangkan persamaan reaksi kimia, Anda tidak perlu mengubah subskrip. Anda hanya perlu menambahkan koefisien yang merupakan pengali bilangan bulat apabila persamaan belum seimbang.
Misalnya, Anda menulis 2 H₂O, maka itu artinya Anda memiliki 2 kali jumlah atom dalam setiap molekul air, yang akan menjadi 4 atom hidrogen dan 2 atom oksigen. Seperti halnya subskrip, Anda tidak menulis koefisien “1”, jadi jika Anda tidak melihat koefisien, maka itu berarti hanya ada satu molekul.
Ada strategi yang akan membantu untuk menyeimbangkan persamaan lebih cepat. Pada dasarnya, ketika Anda melihat berapa banyak atom yang Anda miliki di setiap sisi persamaan, maka lanjutkan dengan menambah koefisien ke molekul untuk menyeimbangkan jumlah atom.
Keseimbangan atom ada dalam satu molekul reaktan dan produk. Seimbangkan atom oksigen atau hidrogen pada langkah terakhir. Sebagai contoh:
Fe + O₂ → Fe₂O₃
Besi ada pada reaktan dan produk, jadi seimbangkan atomnya terlebih dahulu. Ada satu atom besi di sebelah kiri dan dua di sebelah kanan, jadi pilihan pertama mungkin Anda berpikir menempatkan 2 Fe di sebelah kiri akan berhasil.
Sementara setelah menyeimbangkan zat besi, Anda pun tahu harus menyesuaikan oksigen juga, karena tidak seimbang. Tetapi pilihan menempatkan koefisien 2 tetap seimbang, sehingga Anda harus membuang pilihan menggunakan koefisien 2.
Selanjutnya, koefisien 3 Fe tidak berfungsi di sebelah kiri karena Anda tidak dapat memasukkan koefisien dari Fe₂O₃ Itu akan menyeimbangkannya.
Nah, lanjut dengan pilihan apabila memasukkan koefisien 4 pada Fe. Ternyata, 4 Fe bekerja jika Anda kemudian menambahkan koefisien 2 di depan molekul karat (oksida besi), menjadikannya 2 Fe₂O₃. Hasil akhirnya adalah:
4 Fe + O₂ → 2 Fe₂O₃
Besi (Fe) seimbang, dengan 4 atom besi di setiap sisi persamaan. Selanjutnya Anda perlu menyeimbangkan oksigen.
4. Seimbangkan Atom Oksigen dan Atom Hidrogen
Dari persamaan terakhir yang telah dapat:
4 Fe + O₂ → 2 Fe₂O₃
Saat menyeimbangkan persamaan reaksi kimia, langkah terakhir adalah menambahkan koefisien ke atom oksigen dan hidrogen. Alasannya adalah bahwa kedua molekul tersebut biasanya muncul dalam beberapa reaktan dan produk.
Sekarang, lihat persamaan untuk mencari tahu koefisien mana yang akan bekerja untuk menyeimbangkan oksigen. Jika memasukkan koefisien 2 untuk O₂, maka akan menghasilkan 4 atom oksigen. Tetapi Anda memiliki 6 atom oksigen pada bagian kanan (koefisien 2 dikalikan dengan subskrip 3). Jadi, koefisien 2 tidak berfungsi.
Jika mencoba koefisien 3 untuk O₂, maka Anda akan memiliki 6 atom oksigen di sebelah kiri dan juga 6 atom oksigen di sisi kanan. Persamaan kimia menjadi seimbang seperti berikut:
4 Fe + 3 O₂ → 2 Fe₂O₃
Anda juga bisa menulis persamaan yang setara menggunakan kelipatan koefisien. Misalnya, jika menggandakan semua koefisien, maka persamaan seimbang menjadi:
8 Fe + 6 O₂ → 4 Fe₂O₃
Namun, biasanya ahli kimia selalu menulis persamaan yang paling sederhana. Jadi, periksalah hasil dari menyetarakannya untuk memastikan koefisien tersebut tidak berkurang lagi. Langkah terakhir setelah menyeimbangkan persamaan reaksi adalah mencantumkan fase reaksinya (padat, cair, larutan, gas) pada reaktan dan produk.
Sudah Paham dengan Persamaan Reaksi Kimia?
Pemahaman yang kuat tentang persamaan reaksi kimia dan keterampilan menyetarakannya adalah hal yang esensial dalam memahami dasar-dasar kimia. Dengan mengikuti langkah-langkah yang tepat, Anda dapat memastikan bahwa reaksi kimia telah sesuai dengan Hukum Kekekalan Massa dan Konsistensi Atom.
Jangan ragu untuk terus berlatih dengan berbagai contoh untuk meningkatkan keterampilan dalam menyetarakannya dengan efisien dan efektif. Dengan panduan ini, dunia reaksi kimia akan terbuka lebih jauh dan lebih mudah dipahami.