Tahukah Anda bahwa reaksi hidrolisis adalah salah satu proses kimia penting yang sering terjadi di alam dan dalam laboratorium? Secara umum, proses kimia ini selalu berkaitan dengan adanya pemecahan senyawa menjadi komponen-komponen tertentu melalui reaksi dengan air.
Penasaran apa saja jenis-jenis peristiwa di alam yang melibatkan reaksi ini? Jika iya, langsung saja baca artikel ini karena kami akan menjelaskan secara mendalam apa itu hidrolisis, mengidentifikasi berbagai jenisnya, dan mendalami reaksi hidrolisis yang terlibat dalam proses ini.
Apa Itu Hidrolisis?
Istilah hidrolisis berasal dari bahasa Yunani, di mana hydro berarti air dan lysis berarti penguraian. Sehingga, secara teori kata hidrolisis mengacu pada proses pemisahan atau pemecahan senyawa dengan air.
Sebut saja hidrolisis garam yang merupakan reaksi antara ion garam dengan air, sehingga menghasilkan larutan asam atau basa. Dalam hidrolisis garam, beberapa karakteristiknya meliputi:
- Membentuk asam dan basa yang kemudian berinteraksi membentuk garam.
- Tidak terjadi pada garam dengan kation dan anion asam-basa kuat yang sudah terisolasi sempurna.
- Terjadi hanya ketika kation atau anion reaktif.
- Terjadi sebagian jika hanya satu di antara kation atau anion yang bereaksi.
- Hidrolisis total terjadi saat kation dan anion keduanya bereaksi. Contohnya adalah aluminium sulfat (Al₂(SO₄)₃).
Garam, yang umumnya dikenal sebagai kristal putih untuk memberi rasa asin pada makanan, memiliki peran signifikan dalam bidang kimia yang berbeda dari penggunaannya dalam kuliner. Dalam konteks kimia, garam adalah produk dari reaksi netralisasi antara larutan asam dan larutan basa.
Secara umum, reaksi netralisasi terjadi dengan proses sebagai berikut:
Asam + Basa → Garam + Air
Nah, contoh reaksi netralisasi yang mungkin umum Anda temui adalah:
HCl + NaOH → NaCl + H₂O
Garam dapat terbentuk melalui empat jenis reaksi hidrolisis kimia yang berbeda, yaitu:
- Garam dari reaksi antara asam kuat dan basa kuat. Jenis garam ini memiliki sifat netral dengan pH sekitar 7. Contohnya adalah NaCl, KCl, K₂SO₄, dan Ca(NO₃)₂.
- Garam yang terbentuk dari reaksi antara asam kuat dan basa lemah. Garam ini bersifat asam dengan pH kurang dari 7. Contohnya adalah Zn(ClO₄)₂, NH₄Cl, AlCl₃, dan Fe(NO₃)₂.
- Garam dari reaksi antara basa kuat dan asam lemah. Garam ini bersifat basa dengan pH lebih dari 7. Contohnya adalah Na₂SO₃, KCN, Na₂CO₃, dan (CH₃COO)₂Ca.
- Garam dari reaksi antara asam lemah dan basa lemah. Sifat asam atau basa dari garam ini bergantung pada nilai Ka dan Kb dari senyawa tersebut. Contoh garam ini mencakup Zn(NO₂)₂, CH₃COONH₄, dan Fe₃(PO₄)₂.
Apa Itu Reaksi Hidrolisis?
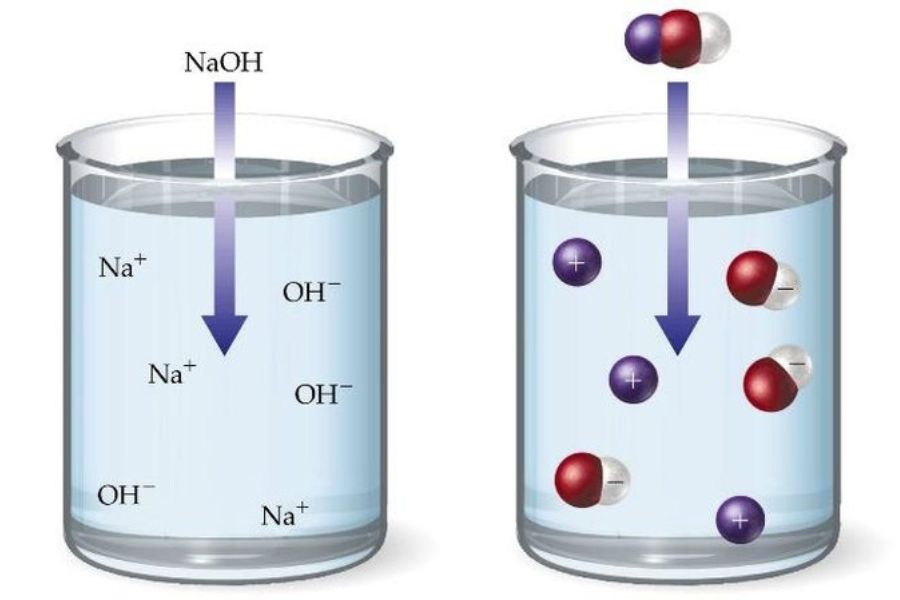
Reaksi hidrolisis garam dapat dibedakan menjadi dua kategori utama, yaitu hidrolisis sempurna dan hidrolisis sebagian. Pada hidrolisis sempurna, seluruh komponen senyawa garam akan terurai sepenuhnya. Sedangkan hidrolisis sebagian membuat hanya sebagian komponen senyawa yang terurai. Berikut ini penjelasan lengkapnya:
1. Reaksi Hidrolisis Sebagian atau Parsial
Hidrolisis sebagian adalah proses di mana sebagian senyawa garam terurai oleh air. Kondisi ini terjadi ketika garam terbentuk dari pasangan basa lemah dan asam kuat, atau pasangan basa kuat dan asam lemah.
Saat terjadi hidrolisis sebagian, air bereaksi dengan komponen asam atau basa lemah dalam garam, dan menghasilkan ion OH⁻ (hidroksida) atau ion H⁺ (hidrogen). Contoh hidrolisis sebagian adalah garam ammonium chloride (NH4Cl) yang menghasilkan larutan sedikit basa karena ion amonium (NH4⁺) bersifat asam lemah.
2. Reaksi Hidrolisis Total atau Sempurna
Hidrolisis total adalah proses di mana semua ion dalam garam bereaksi dengan air, baik itu kation atau anion. Garam yang mengalami hidrolisis total adalah garam yang terbentuk dari pasangan basa lemah dan asam lemah.
Dalam kasus ini, reaksi dengan air menghasilkan ion hidroksida (OH⁻) maupun ion hidrogen (H⁺). Sehingga, larutan menjadi bersifat asam atau basa tergantung pada tingkat hidrolisisnya.
Contoh hidrolisis total adalah garam sodium acetate (CH3COONa), yang menghasilkan larutan bersifat basa karena ion acetate (CH3COO⁻) bersifat asam lemah dan larutan dapat menerima ion hidrogen dari air.
Jenis-jenis Reaksi Hidrolisis Garam

Berdasarkan penjelasan sebelumnya, terlihat bahwa reaksi hidrolisis garam adalah proses kimia di mana garam bereaksi dengan air untuk menghasilkan larutan asam dan larutan basa atau konstituen lainnya. Ada empat jenis reaksi yang didasarkan atas sifat asam dan basa dalam garam tersebut, diantaranya adalah:
1. Garam Asal dari Asam Kuat dan Basa Kuat
Garam ini terbentuk akibat adanya reaksi antara asam kuat dan basa kuat. Karena kedua komponen ini sangat reaktif, garam ini tidak mengalami hidrolisis, sehingga larutan yang terbentuk bersifat netral.
Contohnya, NaCl. Jenis garam seperti NaCl terbentuk dari reaksi antara asam kuat dan basa kuat. Ketika NaCl larut dalam air, ion Na⁺ dan Cl⁻ tidak berpartisipasi dalam reaksi hidrolisis, sehingga garam bersifat netral. Berikut ini bentuk reaksinya:
NaCl (aq) → Na⁺ (aq) + Cl⁻ (aq)
Na⁺ + H₂O ↛ (tak terhidrolisis)
Cl⁻ + H₂O ↛ (tak terhidrolisis)
2. Garam Asal dari Asam Kuat dan Basa Lemah
Garam ini terbentuk dari reaksi antara asam kuat dan basa lemah. Dalam hidrolisisnya, ion yang berasal dari basa lemah dapat melepaskan ion hidrogen (H⁺), sehingga membuat larutan bersifat asam.
Contohnya, garam seperti NH4Cl berasal dari asam kuat dan basa lemah. Dalam proses hidrolisis, ion NH4⁺ menghasilkan ion H⁺, sehingga mengakibatkan larutan ini memiliki karakteristik asam ringan. NH4Cl bersifat asam karena mengalami hidrolisis sebagian, di mana ion NH4⁺ melepaskan ion H⁺ ke dalam larutan.
Berikut reaksi kimianya:
NH4Cl (aq) → NH4⁺ (aq) + Cl⁻ (aq)
NH4⁺ + H2O ⇄ NH4OH + H⁺
Cl⁻ + H2O ↛ (tak terhidrolisis)
3. Garam dari Asam Lemah dan Basa Kuat
Garam ini terbentuk dari reaksi antara asam lemah dan basa kuat. Dalam hidrolisisnya, ion yang berasal dari asam lemah dapat melepaskan ion hidroksida (OH⁻), menjadikan larutan bersifat basa.
Contohnya, garam seperti CH3COONa terbentuk dari asam lemah dan basa kuat. Ketika larut dalam air, ion CH3COO⁻ dapat melepaskan ion OH⁻, menyebabkan larutan memiliki sifat basa ringan. CH3COONa bersifat basa karena mengalami hidrolisis sebagian, di mana ion CH3COO⁻ melepaskan ion OH⁻ ke dalam larutan.
Berikut reaksi hidrolisis dari garam CH3COONa:
CH3COONa (aq) → CH3COO⁻ (aq) + Na⁺ (aq)
CH3COO⁻ + H2O ⇄ CH3COOH + OH⁻
Na⁺ + H2O ↛ (tak terhidrolisis)
4. Garam Asal dari Asam Lemah dan Basa Lemah
Garam ini terbentuk dari reaksi antara asam lemah dan basa lemah. Dalam hidrolisisnya, baik ion yang berasal dari asam lemah maupun basa lemah berpartisipasi, dan karakteristik asam-basa dari larutan ini bergantung pada konstanta kesetimbangan (Ka dan Kb).
Contohnya, garam seperti CH3COONH4 terbentuk dari asam lemah dan basa lemah. Dalam reaksi hidrolisisnya, baik ion CH3COO⁻ maupun NH4⁺ dapat berpartisipasi atau terhidrolisis sempurna, dengan sifat asam atau basa garam ini yang menentukan itu dari konstanta kesetimbangan (Ka dan Kb).
Reaksi hidrolisis garam CH3COONH4 adalah sebagai berikut:
CH3COONH4 (aq) → CH3COO⁻ (aq) + NH4⁺ (aq)
CH3COO⁻ + H2O ⇄ CH3COOH + OH⁻
NH4⁺ + H2O ⇄ NH4OH + H⁺
Dengan kata lain, berbagai jenis reaksi hidrolisis garam dapat Anda bedakan berdasarkan sifat asam dan basa komponen garam. Pada gilirannya, kondisi tersebut akan mempengaruhi pH dan karakteristik larutan yang terbentuk.
Contoh Soal Terkait Reaksi Hidrolisis dan Pembahasan

Sebagai contoh, larutan garam CH3COOK dengan massa 4,9 gram dilarutkan dalam air sebanyak 500 ml. Anda diminta untuk menghitung nilai pH dari larutan garam ini. (Dengan Ar: K=39, C=12, O=16, dan Ka (konstanta asam) dari CH3COOH adalah 10⁵)
Nah, karena garam ini terbentuk dari asam yang relatif lemah dan basa yang kuat, maka hasilnya adalah larutan basa yang memiliki nilai pH di atas 7. Oleh sebab itu, langkah pertama yang harus Anda lakukan adalah menghitung massa molar (Mr) dari garam CH3COOK dengan menjumlahkan massa atom-atom penyusunnya (Ar).
Mr CH3COOK = (2 × Ar C) + (3 × Ar H) + (2 × Ar O) + Ar K
Mr CH3COOK = (2 × 12) + (3 × 1) + (2 × 16) + 39 = 24 + 3 + 32 + 39 = 98 gram/mol
Langkah berikutnya adalah menghitung konsentrasi garam (C atau M) dalam larutan. Konsentrasi ini dapat Anda hitung menggunakan rumus berikut:

Berhubung koefisien garamnya adalah 1, maka konsentrasi ion kation (K+) sama dengan konsentrasi total garam. Selanjutnya, Anda bisa menggunakan persamaan reaksi hidrolisis garam untuk menghitung konsentrasi ion OH⁻ dalam larutan garam.
CH3COOK adalah garam dari asam lemah (CH3COOH) dan basa kuat (KOH), akan menggunakan persamaan sebagai berikut:
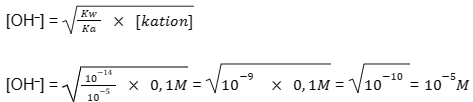
pOH = – log [OH⁻]
pOH = – log [10-5] = 5
pH = 14 – pOH
pH = 14 – 5 = 9
Maka, nilai pH dari larutan garam CH3COOK adalah 9.
Sudah Paham dengan Konsep Reaksi Hidrolisis?
Setelah memahami berbagai aspek reaksi hidrolisis, kini Anda memiliki pemahaman yang lebih baik tentang bagaimana garam dapat mempengaruhi sifat asam-basa larutan. Dari jenis-jenis garam yang berbeda hingga perhitungan pH larutan garam, pengetahuan ini membantu Anda menganalisis sifat kimia dan lingkungan larutan.
Seiring dengan pemahaman lebih mendalam tentang hidrolisis, Anda dapat mengaplikasikan konsep ini dalam berbagai konteks ilmiah dan praktis. Misalnya dalam industri kimia (pembuatan deterjen), pertanian (pembuatan pupuk), hingga pengolahan air limbah industri.

