Dalam bidang ilmu kimia, salah satu konsep mendasar yang perlu Anda pahami adalah reaksi redoks. Singkatnya, reaksi ini terjadi ketika elektron ditransfer antara berbagai zat, yang mana mengarah pada perubahan bilangan oksidasi.
Sebagian orang mungkin akan kebingungan ketika mencoba mengidentifikasi reaktan mana yang teroksidasi dan mana yang tereduksi. Lalu apa perbedaan antara reduksi dan oksidasi? Dalam artikel ini, kita akan membahasnya secara lengkap, termasuk fungsi, ciri khas, serta beberapa contoh penerapan reaksi ini.
Pengertian Reaksi Redoks
Reaksi redoks yang merupakan singkatan dari reduksi-oksidasi adalah reaksi kimia di mana atom mengubah bilangan oksidasinya. Oksidasi terjadi ketika beberapa atom kehilangan elektron. Sedangkan reduksi terjadi saat beberapa atom mendapat elektron.
Oleh karena itu, baik reduksi maupun oksidasi berlangsung secara bersamaan, sehingga istilahnya adalah redoks. Reaksi redoks biasanya terjadi di salah satu dari dua lingkungan, yaitu asam atau basa. Kata-kata oksidasi dan reduksi memiliki beberapa arti yang berbeda dalam bidang ilmu kimia.
Definisi pertama yaitu meninjau dalam hal oksigen. Oksidasi adalah proses ketika mendapatkan oksigen, sedangkan reduksi adalah hilangnya oksigen. Misalnya, ketika tembaga bereaksi dengan oksigen, maka terbentuklah tembaga oksida yang mana tembaga telah teroksidasi.
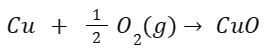
Tetapi, ketika tembaga bereaksi dengan hidrogen, maka tembaga oksida akan memisahkan diri menjadi tembaga dan oksigen. Sehingga, tembaga akan tereduksi.
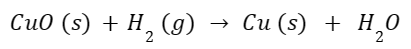
Berdasarkan persamaan di atas, dapat Anda lihat bahwa reaksi reduksi perlu menambahkan hidrogen untuk mengurangi unsur oksigen dalam tembaga oksida. Sehingga, definisi kedua dari reaksi redoks adalah oksida kehilangan hidrogen, dan reduksi adalah proses kembalinya unsur hidrogen.
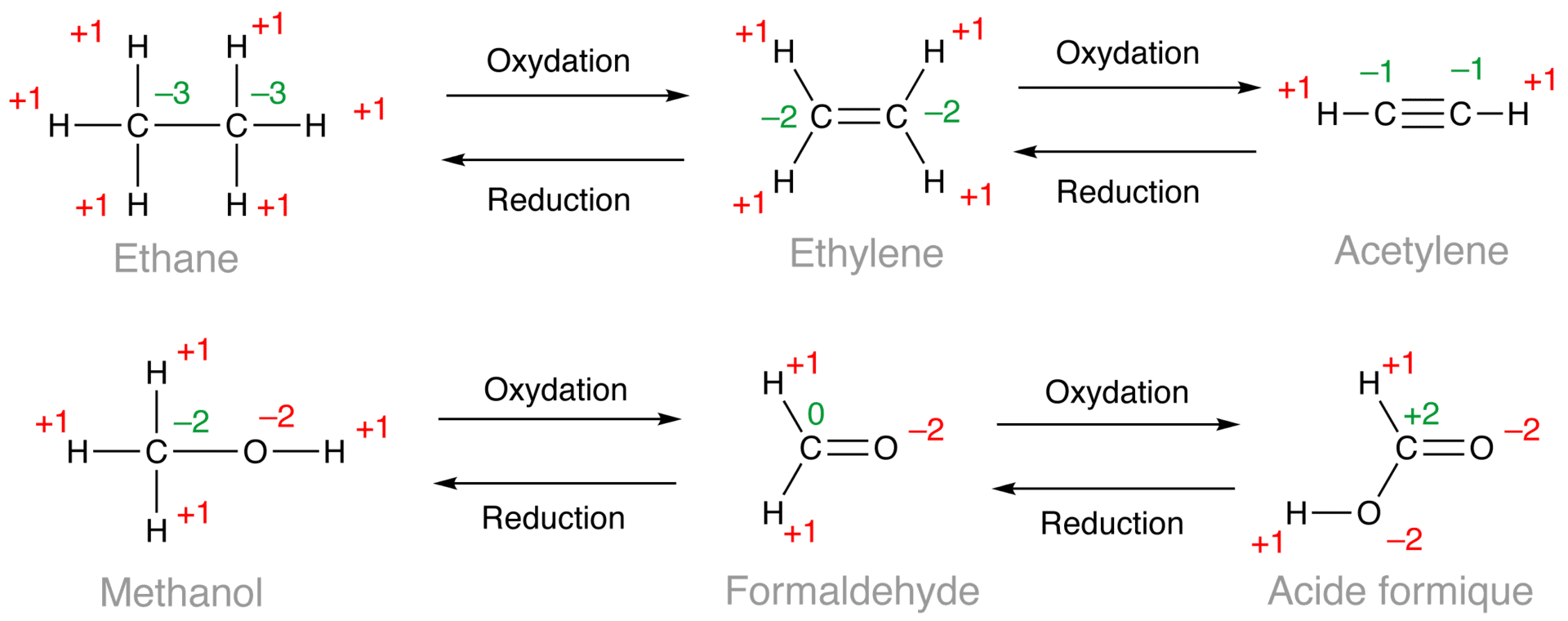
Namun, pada umumnya reaksi ini cenderung mengacu pada pergerakan elektron antar molekul dalam suatu reaksi. Oksidasi adalah hilangnya elektron dan reduksi adalah proses memperoleh elektron.
Singkatnya, oksidasi berarti memperoleh oksigen, kehilangan hidrogen, dan kehilangan elektron. Demikian juga, reduksi berarti kehilangan oksigen, memperoleh hidrogen, dan memperoleh elektron.
Jenis-jenis Reaksi Redoks
Berikut adalah beberapa jenis umum dari reaksi redoks:
1. Reaksi Dekomposisi
Reaksi ini melibatkan pemecahan senyawa menjadi senyawa yang berbeda. Contoh dari jenis reaksi ini adalah:
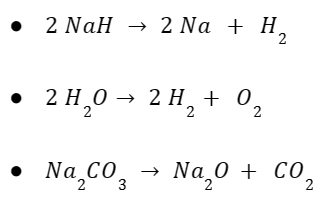
Semua reaksi di atas menghasilkan pemecahan senyawa kimia yang lebih kecil dalam bentuk AB → A + B
2. Reaksi Kombinasi
Reaksi-reaksi ini adalah kebalikan dari reaksi dekomposisi dan karenanya, melibatkan kombinasi dua senyawa untuk membentuk senyawa tunggal dalam bentuk A + B → AB. Sebagai contoh:
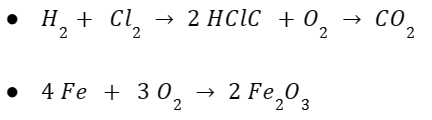
3. Reaksi Perpindahan
Dalam reaksi semacam ini, atom atau ion dalam suatu senyawa tergantikan oleh atom atau ion unsur lain. Hal itu dapat diwakili dalam bentuk X + YZ → XZ + Y. Kategori reaksi perpindahan dalam reaksi redoks lebih lanjut dapat menjadi:
- Reaksi Perpindahan Logam: Dalam jenis reaksi ini, logam yang ada dalam senyawa dipindahkan oleh logam lain. Penerapan jenis reaksi ini adalah dalam proses metalurgi di mana logam murni diperoleh dari bijihnya. Misalnya,
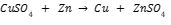
- Reaksi Perpindahan Non-Logam: Pada jenis reaksi perpindahan non logam ini, Anda dapat menemukan perpindahan hidrogen dan kadang-kadang reaksi ini melibatkan perpindahan oksigen.
4. Reaksi Disproporsionasi
Penjelasan reaksi disproporsionasi adalah reaksi di mana reaktan tunggal dioksidasi dan direduksi. Misalnya,
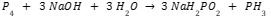
Penggunaan Reaksi Redoks dalam Kehidupan Nyata
Dalam kehidupan nyata, penggunaan reaksi reduksi-oksidasi adalah sebagai berikut:
- Produksi beberapa bahan kimia penting juga mengacu pada elektrolisis, yang pada gilirannya, didasarkan pada reaksi redoks. Berbagai senyawa kimia, termasuk soda kaustik dan klorin, dihasilkan melalui reaksi reduksi oksidasi.
- Reaksi oksidasi-reduksi juga menemukan aplikasi mereka dalam air sanitasi dan bahan pemutihan.
- Logam-logam terlindungi dari korosi dengan menghubungkannya ke anoda korban, yang mengorbankan diri untuk mengalami korosi. Galvanisasi baja adalah contoh umum teknik ini.
- Produksi industri produk pembersih melibatkan proses oksidasi.
- Asam nitrat, komponen penting dalam pupuk, dihasilkan melalui reaksi oksidasi amonia.
- Elektroplating adalah proses yang menggunakan reaksi redoks untuk menerapkan lapisan tipis material pada suatu objek. Teknik ini berguna dalam pembuatan perhiasan berlapis emas.
- Pemisahan logam dari bijihnya dengan bantuan reaksi redoks. Salah satu contohnya adalah peleburan logam sulfida dengan adanya zat pereduksi.
Ciri-ciri Reaksi Redoks

Terdapat beberapa ciri-ciri reaksi redoks yang sering terjadi dalam kehidupan sehari-hari, di antaranya adalah sebagai berikut:
1. Adanya Unsur-unsur Bebas
Pertama, dalam reaksi redoks, unsur-unsur bebas seperti Cl2 (klorin), Cu (tembaga), dan O2 (oksigen) sering terlibat. Unsur-unsur ini dapat berperan sebagai oksidator atau reduktor, tergantung pada kondisi reaksi.
2. Perubahan Biloks
Lalu, dalam reaksi redoks, terjadi perubahan bilangan oksidasi (biloks) pada unsur-unsur yang terlibat. Bilangan oksidasi adalah cara untuk mengekspresikan jumlah elektron yang dipindahkan oleh unsur tersebut dalam reaksi kimia. Perubahan biloks ini menandakan terjadinya reaksi oksidasi dan reduksi.
3. Keberadaan Reduktor
Kemudian, reduktor adalah zat yang mengalami oksidasi dalam reaksi redoks. Reduktor kehilangan elektron dan membantu dalam mengurangi zat lain. Dalam beberapa reaksi, unsur-unsur seperti logam atau senyawa yang memiliki ion-ion negatif (anion) cenderung berperan sebagai reduktor.
4. Keberadaan Oksidator
Selanjutnya, oksidator adalah zat yang mengalami pengurangan dalam reaksi redoks. Oksidator mendapatkan elektron dari zat lain dan membantu dalam mengoksidasi zat tersebut. Contoh oksidator umum adalah oksigen (O2) dalam reaksi pembakaran.
Cara Menentukan Bilangan Oksidasi
Cara-cara menentukan bilangan oksidasi dalam reaksi kimia melibatkan delapan aturan yang dapat Anda pelajari sebagai berikut:
- Unsur bebas dalam bentuk atom atau molekul memiliki bilangan oksidasi 0. Misalnya, unsur bebas seperti C, Ca, Cu, dan O2 memiliki bilangan oksidasi 0.
- Bilangan oksidasi ion tunggal dan ion kompleks menyesuaikan dengan tanda muatan ionnya. Contohnya, ion Na+ memiliki bilangan oksidasi +1, sedangkan ion SO42- memiliki bilangan oksidasi -2.
- Bilangan oksidasi unsur dalam golongan logam IA, IIA, dan IIIA sesuai dengan golongannya. Contohnya, unsur golongan IA seperti Na memiliki bilangan oksidasi +1.
- Bilangan oksidasi unsur dalam golongan transisi (golongan B) bisa lebih dari satu. Misalnya, Cu memiliki bilangan oksidasi +1 dan +2.
- Jumlah bilangan oksidasi memiliki unsur-unsur yang membentuk ion haruslah sama dengan muatan ionnya. Contohnya, ion NH4+ memiliki total bilangan oksidasi +1.
- Jumlah bilangan oksidasi memiliki unsur-unsur dalam sebuah senyawa harus nol. Sebagai contoh, dalam H2O, bilangan oksidasi H adalah +1 dan O adalah -2, yang ketika dijumlahkan memberikan total nol.
- Bilangan oksidasi hidrogen (H) dalam senyawa tergantung pada apakah ia berikatan dengan logam atau non-logam. Jika berikatan dengan logam, maka bilangan oksidasi H adalah -1, sedangkan jika berikatan dengan non-logam, maka bilangan oksidasi H adalah +1.
- Bilangan oksidasi oksigen (O) dalam senyawa peroksida adalah -1, sedangkan dalam senyawa non-peroksida adalah -2. Sebagai contoh, dalam BaO2, bilangan oksidasi O adalah -1.
Penyetaraan Reaksi Redoks

Penyetaraan reaksi reduksi-oksidasi umumnya terjadi dalam larutan air, melibatkan ion H+ dan OH-. Dua metode yang digunakan adalah metode setengah reaksi dan metode perubahan bilangan oksidasi.
1. Penyetaraan dengan Metode Setengah Reaksi
Pada metode ini, langkah-langkahnya melibatkan penyetaraan jumlah elektron dalam reaksi reduksi dan oksidasi terpisah. Langkah-langkahnya adalah sebagai berikut:
- Tuliskan persamaan setengah reaksi reduksi dan oksidasi.
- Setarakan unsur yang mengalami perubahan bilangan oksidasi.
- Tambahkan H2O untuk menyeimbangkan atom oksigen.
- Setarakan atom hidrogen dengan ion H+ dalam suasana asam atau ion OH- dalam suasana basa.
- Setarakan muatan dengan menambahkan elektron.
- Jumlahkan kedua persamaan setengah reaksi.
2. Penyetaraan dengan Metode Bilangan Oksidasi
Metode ini berfokus pada penyamaan perubahan bilangan oksidasi dalam reaksi redoks. Langkah-langkahnya adalah sebagai berikut:
- Setarakan atau seimbangkan jumlah unsur yang mengalami perubahan nilai bilangan oksidasi.
- Tentukan bilangan oksidasi dan perubahannya.
- Setarakan perubahan bilangan oksidasi.
- Hitung total muatan pada kedua sisi reaksi.
- Tambahkan ion H+ jika sisi kiri lebih negatif atau ion OH- jika lebih positif.
- Seimbangkan jumlah atom hidrogen dengan menambahkan H2O pada sisi kanan.
Metode perubahan bilangan oksidasi mengandalkan prinsip bahwa jumlah elektron yang teroksidasi sama dengan jumlah yang tereduksi. Kondisi tersebut dapat diterapkan pada reaksi molekul dan ion dengan menggunakan prinsip bilangan oksidasi.
Sudah Lebih Paham dengan Konsep Reaksi Redoks?
Dalam kesimpulannya, reaksi redoks, dengan perubahan bilangan oksidasi dan pertukaran elektron, adalah konsep inti dalam ilmu kimia. Oksidasi dan reduksi terjadi bersamaan dalam suatu reaksi, memberikan dampak yang luas dalam industri dan fenomena alami. Pemahaman tentang reaksi redoks penting dalam berbagai aplikasi, termasuk dalam pembuatan baterai, proses korosi, produksi logam dari bijih, serta reaksi kimia yang terjadi dalam dunia biologi. Dengan demikian, pengetahuan tentang reaksi reduksi dan oksidasi membangun dasar pemahaman yang kuat dalam dunia kimia.

