Senyawa merupakan zat kimia yang terbentuk akibat adanya proses secara kimia. Namun, pembentukan senyawa bisa terjadi secara alami maupun melalui proses buatan yang manusia lakukan. Lalu, bagaimana proses pembentukannya dan apa saja sifat senyawa kimia itu?
Tersusun dari Apakah Senyawa Kimia itu?
Rumus kimia atau rumus molekul melambangkan identitas suatu senyawa kimia. Setiap rumus kimia mengidentifikasikan komposisi, jumlah, dan unsur atom penyusunnya. Salah satu contoh senyawa adalah air (H2O), karbon monoksida (CO), dan karbon dioksida (CO2).
Pada dasarnya, senyawa kimia merupakan zat tunggal atau unsur yang terbentuk akibat adanya suatu reaksi dan dapat terurai kembali. Air (H2O) merupakan contoh senyawa yang terdiri dari susunan satu oksigen dan dua hidrogen.
Ada reaksi terjadi antara gas hidrogen dengan gas oksigen sehingga menghasilkan molekul air. Kedua atom bergabung membentuk satu senyawa menghasilkan sifat senyawa kimia yang baru. Berikut ini adalah persamaan reaksinya:
2H2(g) + 2O2 (g) —-> 2H2O (l)
Unsur penyusun molekul air masing-masing berbentuk gas, ketika bergabung membentuk suatu senyawa maka karakter senyawa kimianya berubah menjadi cairan.
Menurut proses elektrolisis, molekul air dapat terurai kembali menjadi unsur-unsur pembentuknya, di bawah ini adalah persamaan reaksinya:
2H2O(l) —–> 2H2 (g) + 2O2 (g)
Persamaan reaksi tersebut membuktikan bahwa sifat suatu produk akan berbeda dengan reaktannya. Gas hidrogen dan gas oksigen memiliki sifat mudah terbakar. Setelah keduanya bergabung menjadi satu, molekul air ini berbentuk cair yang berguna untuk memadamkan api.
Susunan senyawa kimia juga berkaitan erat dengan komposisi senyawa. Senyawa kimia terbentuk dari unsur-unsur dengan perbandingan massa yang tetap. Joseph Louis Proust mengemukakan postulat (dalil) tersebut, sehingga biasa dikenal dengan hukum Proust atau hukum perbandingan tetap.
Untuk mengenali komposisinya, senyawa kimia dapat dianalisis menggunakan dua cara, yaitu analisa kualitatif dan analisa kuantitatif. Identifikasi berdasarkan karakteristik unsur merupakan analisis kualitatif, sedangkan identifikasi berdasarkan jumlah unsur yang mengikatnya disebut analisis kuantitatif.
Apa Sajakah Ciri & Sifat Senyawa Kimia Itu?
Seperti telah disinggung dalam penjelasan sebelumnya, sifat-sifat yang melekat pada senyawa kimia berubah-ubah sesuai dengan unsur pembentuknya. Ciri-ciri senyawa kimia antara lain adalah:
- terbentuk dari setidaknya dua unsur yang disusun melalui reaksi kimia,
- senyawa kimia tidak bisa diuraikan secara fisika, dan
- sifat zat asalnya akan berubah dan kehilangan zat asalanya seiring dengan pembentukan senyawa.
Senyawa kimia memiliki wujud yang berbeda dalam masing-masing fase pembentukan. Umumnya, senyawa berwujud zat padat, tetapi bisa juga berupa zat cair atau gas. Dalam kondisi yang sama, wujud suatu senyawa kimia berbeda dengan unsur pembentuknya.
Ada lima sifat atau karakteristik umum yang melekat pada senyawa kimia, yaitu:
- Sifat suatu senyawa kimia tidak sama dengan unsur penyusunnya.
- Perbandingan komponen penyusun senyawa kimia bersifat tetap.
- Senyawa bersifat zat tunggal.
- Pembentukannya dapat terjadi melalui reaksi kimia.
- Jika melalui reaksi kimia, senyawa tetap melekat pada komponen atau unsur-unsur penyusunnya.
2 Macam Senyawa Kimia Berdasarkan Asalnya
Secara umum, senyawa kimia terbagi atas kimia organik dan anorganik yang berdasarkan asal mula terbentuknya suatu senyawa.
1. Senyawa Kimia Organik
Senyawa organik merupakan senyawa yang berasal dari makhluk hidup (manusia, hewan, tumbuhan). Kimia organik sendiri merupakan bidang ilmu yang mempelajari struktur, komponen, sifat, reaksi dan senyawa organik maupun sintesis organik.
Senyawa kimia organik tersusun atas karbon, oksigen, nitrogen, dan senyawanya yang biasa disebut molekul organik. Secara lebih rinci, senyawa organik tersusun atas atom-atom Hidrogen (H), Nitrogen (N), Karbon (C), Halogen (F, Cl, Br, I), Fosfor (P) dan lainnya.
Kebanyakan senyawa organik bersifat mudah terbakar, dan dapat ditemukan bahkan pada tubuh manusia dan tanaman, seperti lemak, karbohidrat, atau protein. Contoh yang paling sederhana dari senyawa organik tersebut adalah gula (C6H1206), cuka (CH3COOH), dan alkohol (-OH).
2. Senyawa Kimia Anorganik
Seperti teori sebelumnya, senyawa yang tersusun atas karbon, hidrogen, atau oksigen merupakan senyawa organik. Namun, ada beberapa senyawa anorganik yang mengandung atom karbon dan oksigen, seperti CaCO3, HCN, HCl, HNO3.
Secara umum, senyawa anorganik tersusun atas material tak hidup. Di alam semesta ini terdapat sangat banyak senyawa yang tergolong anorganik. Misalnya saja tanah, batu, serta api.
Dalam rumus kimianya, senyawa anorganik yang biasa kamu jumpai berbentuk asam klorida (HCl), garam dapur (NaCl), gas oksigen (O2), alumunium hidroksida (Al(OH3)), dan asam nitrat (HNO3).
Mengenal Senyawa Hidrokarbon
Hidrokarbon alifatik merupakan senyawa organik yang mengikat atom hidrogen dan karbon dalam rantai lurus. Sedangkan hidrokarbon aromatik merupakan senyawa yang memiliki cincin aromatik.
Apa itu Hidrokarbon Alifatik?
Sifat senyawa kimia hidrokarbon alifatik dapat berupa jenuh dan tak jenuh. Senyawa alifatik jenuh merupakan senyawa yang memiliki ikatan tunggal, sedangkan senyawa alifatik tak jenuh memiliki ikatan rangkap. Ada dua jenis senyawa yang memiliki sifat ini.
a) Senyawa Alkana
Alkana merupakan senyawa hidrokarbon yang paling sederhana. Struktur senyawa ini berbentuk rantai terbuka dan semua ikatan atomnya merupakan ikatan tunggal.
Salah satu keunikan dalam alkana adalah memiliki sifat yang non reaktif. Alasannya adalah senyawa yang tidak memiliki ikatan rangkap, seperti alkana, cenderung memiliki kereaktifitasan yang rendah.
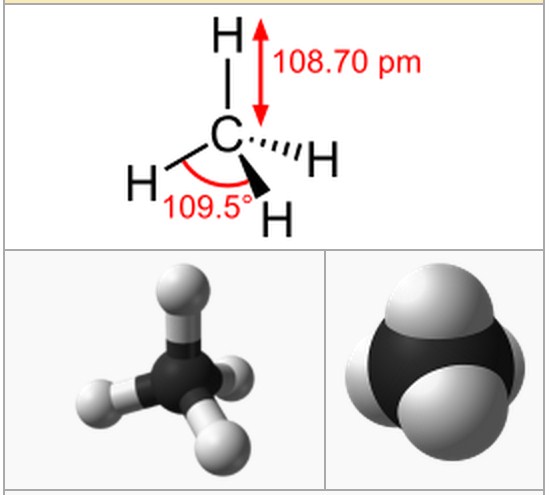
Contoh struktur yang paling sederhana dari senyawa alkana adalah metana (CH4).
b) Senyawa Alkena & Alkuna
Selanjutnya, hidrokarbon yang memiliki sifat tak jenuh adalah senyawa alkena dan alkuna. Mereka memiliki ikatan rangkap dua (alkena) dan ikatan rangkap tiga (alkuna).
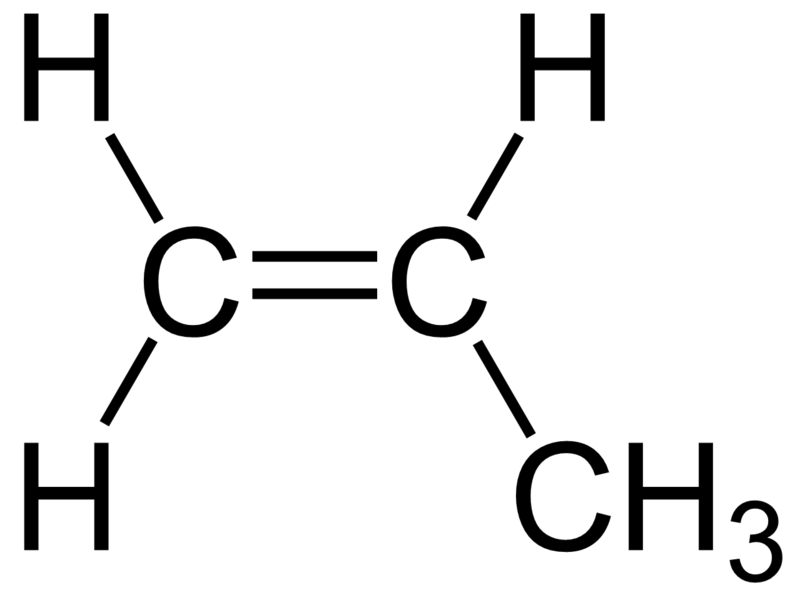
Ketidakjenuhan dalam suatu ikatan mengakibatkan senyawa alkena dan alkuna bersifat sangat reaktif. Contoh struktur alkena berikut adalah 1-propena.
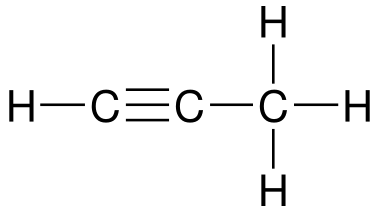
Contoh struktur senyawa alkuna adalah 1-propuna dengan susunan sebagai berikut.
Apa yang Dimaksud dengan Hidrokarbon Aromatik?
Hidrokarbon aromatik tersusun atas enam atom karbon yang biasa disebut cincin benzena. Umumnya, hidrokarbon aromatik terdiri dari satu atau dua cincin yang terkonjugasi. Berdasarkan sifatnya, cincin benzena ini termasuk senyawa non polar yang bersifat tak jenuh. Berikut ini adalah struktur benzena.
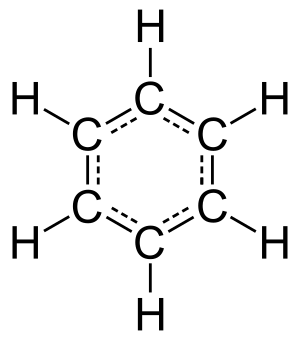
Macam-Macam Senyawa Anorganik & Sifatnya
Kamu dapat menemukan senyawa anorganik dalam bentuk senyawa oksida, asam, basa, dan garam. Berikut ini adalah penjelasan singkat contoh senyawa anorganik yang ada di sekitar kamu, berikut sifat-sifatnya.
1. Senyawa Oksida
Ciri senyawa oksida adalah terdapat atom oksigen di dalamnya. Senyawa oksida terbagi menjadi 2 jenis yaitu, oksida logam dan oksida bukan logam
Berdasarkan kelarutannya, sifat senyawa kimia oksida dapat larut dalam pelarut air. Oksida logam menghasilkan produk bersifat basa, sedangkan oksida bukan logam membentuk asam. Berikut ini adalah daftar contoh senyawa oksida asam dan senyawa oksida basa.
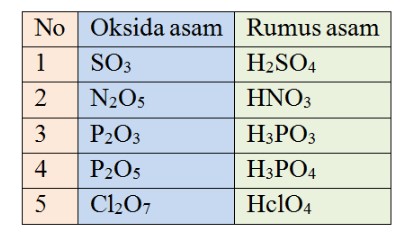
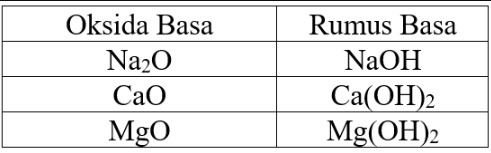
2. Senyawa Asam
Berdasarkan bentuknya, dalam keadaan cair, senyawa asam dapat menghantarkan listrik. Larutan asam dalam keadaan terionisasi akan menghasilkan ion hidrogen (H+) dan ion sisa asam.
Ciri-ciri senyawa asam, antara lain yaitu:
- tersusun atas unsur H, unsur logam, dan unsur O,
- terbentuk dari unsur H dengan unsur halogen (senyawa halida),
- asam pada senyawa organik yang disebut asam karboksilat.
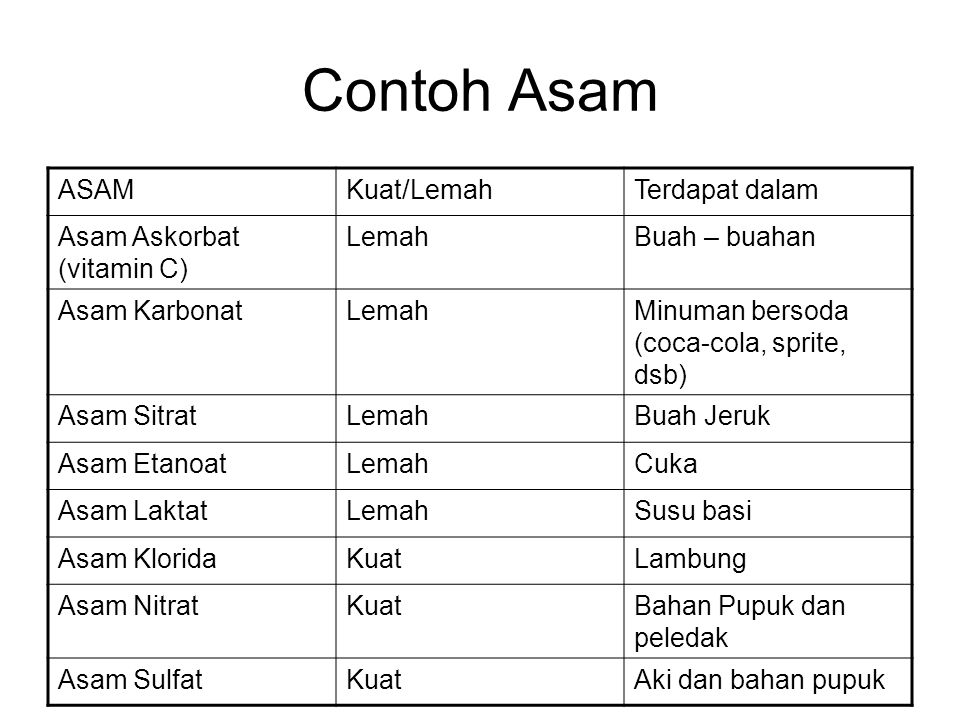
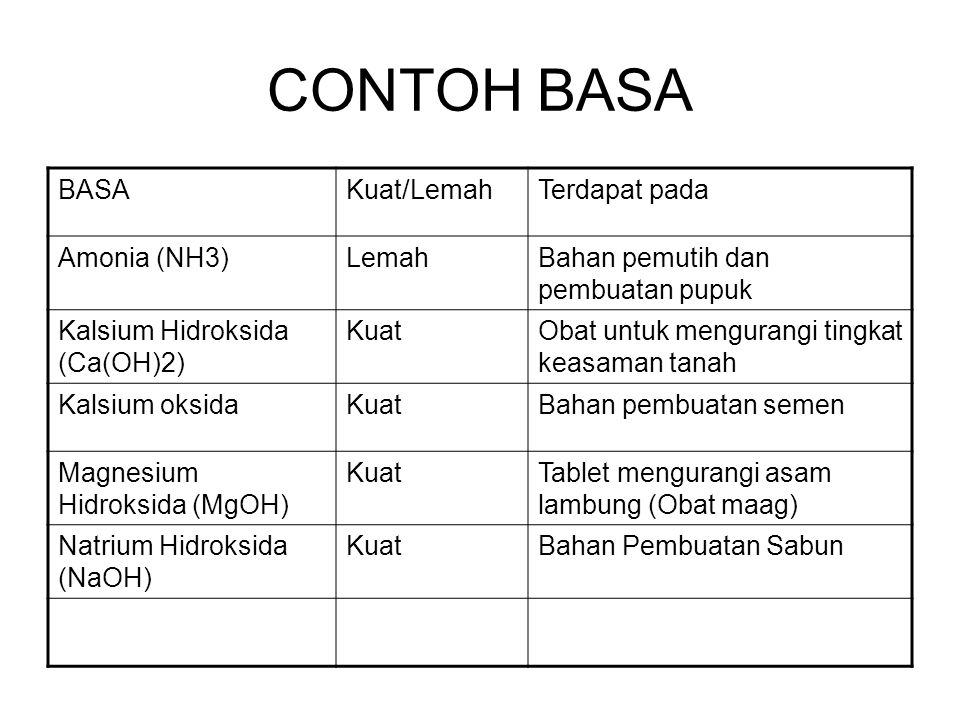
3. Senyawa Basa
Sifat senyawa kimia memiliki rasa getir dan pahit. Jika terkena kulit akan terasa gatal. Dalam bentuk larutan, senyawa basa akan mengalami ionisasi sehingga dapat menghantarkan arus listrik.
Hasil ionisasi larutan basa adalah ion logam dan gugus OH. Oleh karena itu, senyawa basa tersusun atas unsur logam dengan gugus hidroksida (OH).
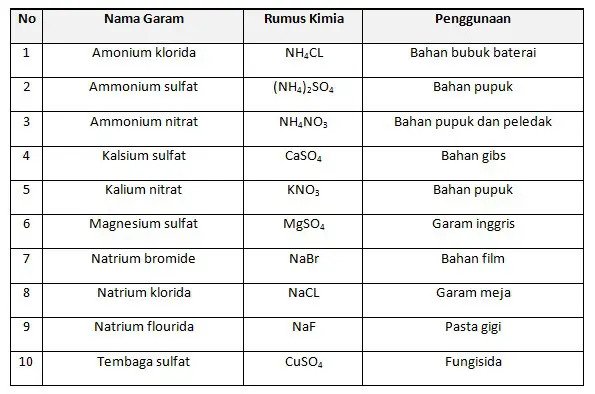
4. Senyawa Garam
Garam adalah memiliki karakteristika rasa asin dan dapat menghantarkan arus listrik. Contoh senyawa garam adalah garam dapur (NaCl), senyawa tersebut akan terionisasi menjadi ion H+ dan Cl–.
Apa Bedanya Senyawa Organik dan Anorganik?
Berdasarkan sifat senyawanya, ada lima perbedaan senyawa organik dan anorganik untuk acuan pembelajaran terkait senyawa kimia.
| Senyawa Organik | Senyawa Anorganik |
| Berasal dari makhluk hidup | Berasal dari alam |
| Bersifat mudah terbakar | Tidak mudah terbakar |
| Penyusun utamanya adalah karbon | Dapat membentuk senyawa tanpa adanya atom karbon |
| Titik didih dan titik lebur cenderung rendah | Titik didih dan titik lebur cenderung tinggi |
| Larut dalam pelarut organik | Dapat larut dalam pelarut air maupun organik |
Bagaimana Penggambaran Sifat Senyawa Kimia Itu?
Suatu senyawa yang tersusun atas satu unsur disebut dengan molekul unsur. Biasanya terkenal dengan senyawa diatomik. Jika senyawa tersusun atas unsur yang berbeda maka penyebutannya adalah senyawa heteroatom.
Contoh molekul unsur adalah O2, H2, N2. Sedangkan molekul senyawa heteroatom antara lain, P2O5, N2O3, H2SO4.
Tentunya, masing-masing suatu molekul membawa unsur sifat atau karakter yang berbeda-beda. Di samping itu, perlu kamu pahami pula bahwa setiap molekul memiliki sifat kimia yang berbeda terhadap unsur pembentuknya.Sama halnya dengan komposisi suatu senyawa. Menurut hukum perbandingan tetap (hukum Proust), setiap sampel tersusun dari komposisi unsur yang sama meskipun dibuat dengan cara yang berbeda.