Termokimia adalah cabang ilmu yang sangat penting dalam bidang fisika dan kimia. Ilmu ini berkaitan dengan pemahaman studi energi, konversi energi antara berbagai bentuk dan kemampuan energi untuk melakukan pekerjaan.
Hampir semua proses kimia melibatkan penyerapan atau pelepasan panas. Pada artikel ini, Anda dapat menjelajahi mengenai pengertian hingga sistem termokimia serta melihat beberapa contoh bagaimana termokimia berperan dalam kehidupan sehari-hari.
Apa Itu Termokimia?
Termokimia adalah bagian dari termodinamika yang menjelaskan hubungan antara kimia dan energi. Secara spesifik, termokimia adalah suatu cabang ilmu yang mempelajari perubahan energi panas yang terlibat dalam berbagai reaksi kimia.
Istilah termokimia berasal dari kata “thermo” yang berarti panas, dan “kimia” yang berarti studi tentang molekul dan reaksi. Sehingga, ilmu ini sangat penting dalam memahami berbagai aspek kimia, mulai dari pembakaran bahan bakar hingga reaksi dalam dunia biologi.
Energi dari panas dapat melakukan penyerapan (endotermik) atau dapat melepaskan dari reaksi kimia tertentu (eksotermik). Kaitan utamanya adalah adanya perubahan energi terutama mengenai pertukaran suatu sistem dengan lingkungannya.
Sejarah Termokimia
Ahli kimia Prancis Antoine Laurent Lavoisier (1743-1794) dan matematikawan Prancis Pierre Simon de Laplace (1749-1827) telah mengemukakan konsep termokimia sekitar tahun 1780. Kedua ilmuwan menunjukkan bahwa hasil panas suatu reaksi sama dengan panas yang diserap dalam reaksi yang berlawanan.
Enam puluh tahun kemudian, seorang kimiawan asal Swiss-Rusia bernama Henri Hess (1802-1850) menunjukkan bahwa jumlah panas yang dihasilkan dalam reaksi adalah hasil dalam serangkaian langkah atau sebagai hasil dari satu langkah reaksi. Teori yang ia kemukakan kini terkenal sebagai Hukum Hess.
Konsep Dasar Termokimia
Berdasarkan definisinya di atas, terlihat bahwa termokimia berfokus pada perubahan energi yang terjadi selama reaksi kimia. Kondisi tersebut secara tidak langsung telah mencakup beberapa aspek penting, yaitu:
1. Hukum Pertama Termodinamika

Salah satu konsep dasar dalam termokimia adalah hukum pertama termodinamika. Istilah lain yang mungkin juga sering Anda dengar dari hukum pertama termodinamika adalah Hukum Kekekalan Energi.
Hukum ini menyatakan bahwa energi tidak dapat tercipta atau musnah, tetapi hanya dapat berubah dari satu bentuk ke bentuk lainnya. Dalam konteks termokimia, kondisi ini berarti bahwa energi yang terlibat dalam reaksi kimia harus datang dari lingkungan sekitarnya atau terserap oleh lingkungan sekitarnya.
Hukum pertama termodinamika juga dapat dinyatakan dalam persamaan matematis sebagai berikut:
ΔU = Q−W
Keterangan:
- ΔU = perubahan energi dalam sistem.
- Q = jumlah kalor yang ditambahkan ke sistem (jika positif) atau dilepaskan oleh sistem (jika negatif).
- W = kerja yang dilakukan oleh sistem (jika positif) atau pada sistem (jika negatif).
2. Kalorimetri
Kalorimetri dalam termokimia adalah bidang ilmu yang berhubungan dengan pengukuran keadaan benda dengan aspek termal untuk memeriksa perubahan fisika dan kimianya. Contohnya pada peleburan, penguapan, pembakaran, netralisasi asam-basa, dan lain-lain.
Kalorimeter adalah apa yang Anda gunakan untuk mengukur perubahan termal tubuh. Kalorimetri diterapkan secara luas di bidang termokimia dalam menghitung entalpi, stabilitas, kapasitas panas, dan lain-lain.
3. Entalpi
Entalpi adalah energi yang ditransfer antara suatu sistem dan lingkungan di bawah tekanan konstan. Anda tidak dapat mengukur entalpi absolut suatu sistem, tetapi dapat mengukur perubahan entalpi untuk suatu proses.
Jika keadaan awal dan akhir memiliki entalpi, maka perubahan entalpi untuk proses tersebut dapat Anda definisikan sebagai:
H = Hf – Hi
Definisi ini hanya berlaku jika H adalah fungsi keadaan, yaitu perubahan entalpi yang hanya bergantung pada keadaan awal dan akhir, bukan pada proses itu sendiri.
Jika Anda hanya mengukur panas yang berevolusi (atau terserap) selama suatu proses, maka Anda tidak akan memiliki ukuran perubahan entalpi karena secara umum q bukan fungsi keadaan. Sehingga, Anda perlu membatasi pengukuran proses pada kondisi tertentu agar dapat mengukur entalpi secara langsung.
Dalam hal ini, jika Anda mempertahankan tekanan konstan dan kemudian hanya mengukur panas yang ditransfer sebagai hasil dari proses (qp), maka Anda akan memiliki ukuran perubahan entalpi. Sehingga, H = qp .
Panas terukur pada tekanan konstan. Maka, rumus entalpi dalam termokimia adalah:
H = pHp – rHr
Subskrip p dan r masing-masing mengacu pada produk dan reaktan. Jika ΔH negatif, maka ada aliran panas nett dari sistem kimia ke lingkungan (panas terlepas selama reaksi). Proses semacam ini disebut eksotermik. Jika ΔH positif, maka aliran nett panas dari lingkungan ke sistem kimia (diserap panas).
4. Kapasitas Panas
Kapasitas panas suatu zat menggambarkan jumlah panas yang dapat terserap oleh zat untuk kenaikan suhu satuan tertentu (satuan = 1 K). Rumus kapasitas panas secara umum adalah:
C = qT
Kapasitas panas dapat Anda nyatakan sebagai fungsi dari jumlah material. Untuk kapasitas panas per mol adalah kapasitas panas molar (satuan J K⁻¹ Mol⁻¹). Lain halnya dengan kapasitas panas per gram adalah kapasitas panas spesifik (atau hanya panas spesifik) (satuan J K⁻¹ g⁻¹).
Jenis Reaksi Termokimia
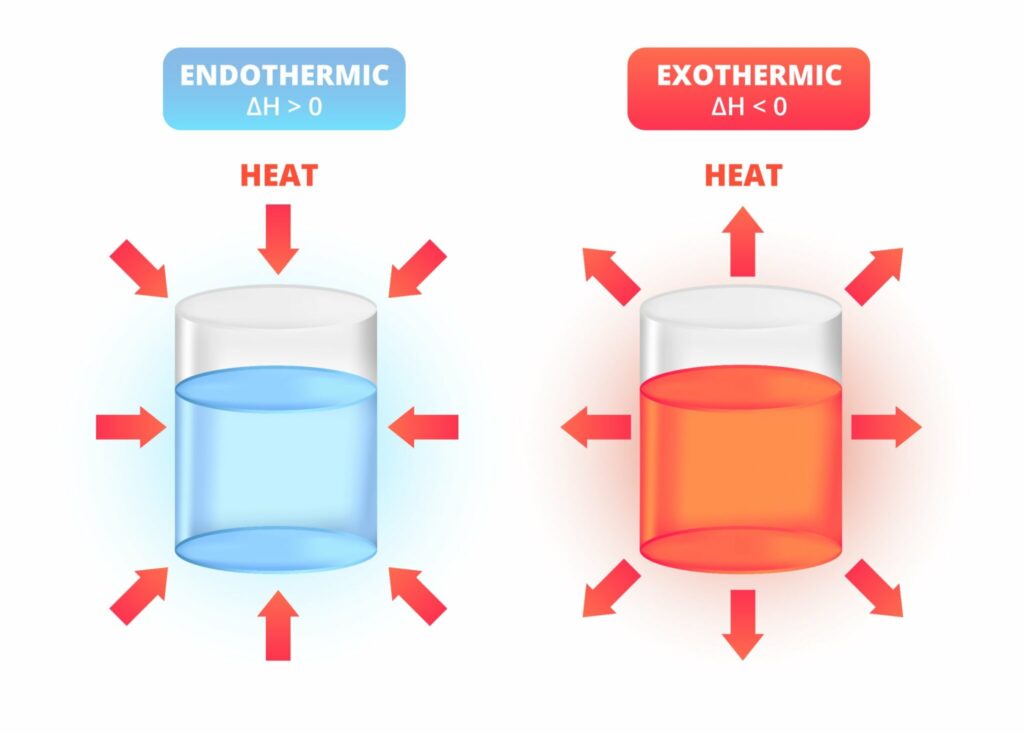
Nah, dari aspek-aspek dasarnya, terdapat beberapa jenis reaksi termokimia yang dapat Anda identifikasi berdasarkan perubahan energi termal yang terjadi selama reaksi tersebut. Berikut adalah beberapa jenis reaksi termokimia utama:
1. Reaksi Endotermik
Reaksi endotermik merujuk pada reaksi termokimia yang menyerap panas. Perubahan entalpi reaksi ini bernilai positif dan senyawa yang terbentuk pada reaksi endotermik adalah senyawa endoterm.
Jika panas yang terserap semakin banyak, maka produk yang terbentuk akan kurang stabil. Contoh dari reaksi ini adalah reaksi dekomposisi, reaksi fusi, reaksi penguapan, reaksi sublimasi, dan fotosintesis.
2. Reaksi Eksotermik
Reaksi eksotermik dari jenis termokimia adalah reaksi suatu panas atau energi yang terlepas selama reaksi. Oleh sebab itu, perubahan entalpi reaksi eksotermik adalah negatif dan senyawa yang terbentuk pada reaksi eksotermik adalah senyawa eksotermik.
Semakin banyak panas yang terlepas, maka produk yang terbentuk akan semakin stabil. Contohnya seperti reaksi pembakaran, reaksi netralisasi, respirasi, dan fermentasi.
Macam-macam Sistem dalam Termokimia
Secara teori, suatu benda atau kumpulannya dapat Anda sebut sebagai sistem. Contohnya seperti bahan kimia, campuran reaksi, dan wadahnya. Sedangkan segala sesuatu yang tidak termasuk dalam sistem adalah lingkungan.
Nah, sistem dan lingkungan dalam termokimia terpisah oleh batas yang merupakan batas fisik atau konseptual yang memungkinkan Anda untuk memahami interaksi antara sistem dan lingkungan.
Misalnya, jika suatu sistem terdapat satu mol gas dalam wadah, maka sistem tersebut adalah satu mol gas. Dinding bagian dalam wadah adalah batas pemisah sistem dengan lingkungan sekitarnya, serta segala sesuatu yang ada. Sedangkan bagian luar batas atau sekitarnya dapat Anda anggap sebagai lingkungan.
Dalam konsep termokimia, terdapat beberapa jenis sistem yang berguna untuk memahami perubahan energi selama reaksi kimia, diantaranya adalah:
- Sistem Terbuka: Sistem yang dapat melakukan pertukaran energi dan materi dengan lingkungannya. Contohnya seperti kompor dengan uap air dan panas yang bisa hilang ke atmosfer.
- Sistem Tertutup: Sistem yang hanya dapat bertukar energi dengan lingkungannya, bukan materi. Contohnya seperti ketika Anda memasang tutup panci dengan sangat rapat.
- Jenis Sistem Terisolasi: Sistem yang tidak dapat bertukar materi atau energi dengan lingkungannya. Salah satu contohnya adalah pendingin minuman berinsulasi dengan penutup.
Contoh Penerapan Termokimia dalam Industri dan Kehidupan Sehari-hari

Termokimia memiliki berbagai penerapan dalam industri dan kehidupan sehari-hari yang sangat penting. Berikut adalah beberapa contoh penerapan termokimia:
- Memasak: Ketika Anda memanaskan air untuk mendidihkan telur, energi panas terserap oleh air untuk mencapai titik didih. Setelah itu, air panas berguna untuk memasak telur.
- Sistem Pemanas Rumah: Ketika sistem pemanas rumah menghasilkan panas, maka energi panas terlepas ke dalam ruangan untuk meningkatkan suhu. Sebaliknya, ketika AC mengeluarkan udara dingin, maka ia menyerap panas dari dalam ruangan.
- Baterai: Baterai dalam perangkat elektronik mengandung reaksi kimia yang menghasilkan energi listrik. Selama penggunaan, reaksi kimia akan berlanjut, dan energi listrik akan terlepas untuk menggerakkan perangkat.
- Fotosintesis Tanaman: Selama fotosintesis, tanaman menyerap energi dari matahari dan mengubahnya menjadi energi kimia yang disimpan dalam bentuk gula. Proses ini penting untuk kelangsungan hidup semua makhluk hidup di bumi.
- Industri Kimia: Utamanya dalam desain dan pengembangan proses kimia untuk mengoptimalkan proses produksi dan mengurangi pemborosan energi.
- Industri Energi: Contohnya pembangkit listrik tenaga nuklir yang menggunakan reaksi nuklir dalam reaktor untuk menghasilkan energi panas yang kemudian bermanfaat untuk menghasilkan listrik.
- Bidang Kimia Farmasi: Industri farmasi memanfaatkan termokimia dalam sintesis obat untuk pengembangan obat-obatan yang aman dan efektif.
- Penelitian Ilmiah: Para ilmuwan dapat memahami mekanisme reaksi, memprediksi perilaku zat dalam berbagai kondisi, dan merancang eksperimen yang tepat.
Sudah Paham Peran Penting Konsep Termokimia?
Pada intinya, cabang ilmu kimia seperti termokimia adalah kunci penting dalam upaya memahami bagaimana energi teraplikasikan dalam reaksi kimia. Konsep dasar seperti reaksi eksotermik dan endotermik, hukum pertama termodinamika, dan peran energi panas dalam berbagai proses kimia adalah bagian dari termokimia.
Selain berperan dalam kehidupan sehari-hari, termokimia juga memiliki banyak aplikasi dalam industri dan penelitian ilmiah. Anda dapat memahami perubahan energi dalam sistem alamiah maupun buatan manusia. Termasuk pengembangan material superkonduktor hingga memahami siklus karbon dan nitrogen.
Dengan memahami prinsip-prinsip termokimia, Anda dapat mengoptimalkan penggunaan energi dalam berbagai aspek kehidupan dan mengembangkan teknologi yang lebih efisien.

