Ketika Anda mempelajari ilmu atom, Anda akan menemukan tiga konsep penting yang sering kali menjadi perhatian, yaitu isotop isoton isobar. Pasalnya, ketiga konsep tersebut dapat membantu Anda memahami variasi dan perbedaan antara atom-atom dalam suatu unsur kimia.
Artikel ini akan mengupas tuntas pengertian, ciri-ciri, perbedaan, serta memberikan contoh-contoh isotop isoton isobar. Maka dari itu, simak penjelasan lengkap artikel ini sampai habis, ya!
Pengertian Isotop Isoton Isobar
Pertama-tama, mari kita pahami terlebih dahulu masing-masing konsep dari isotop isoton isobar di bawah ini:
1. Pengertian Isotop
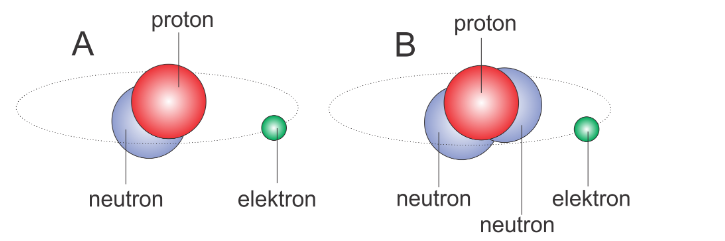
Isotop merujuk kepada atom-atom dari suatu unsur kimia tertentu yang memiliki kesamaan jumlah proton dalam inti atomnya. Lantaran jumlah proton direpresentasikan sebagai nomor atom, maka isotop-isotop memiliki nomor atom yang identik.
Namun, jumlah neutron atom-atom tersebut tetap berbeda di dalam inti atomnya. Jadi, inti atom isotop memiliki proton yang sama, tetapi massa atomnya berbeda akibat variasi jumlah neutron. Maka dari itu, fenomena ini menghasilkan atom-atom dengan berat atom yang berbeda untuk unsur kimia yang sama.
Sebagai contoh, unsur hidrogen memiliki tiga isotop utama, yaitu protium (H-1), deuterium (H-2), dan tritium (H-3). Semuanya memiliki satu proton dalam inti atom, tetapi jumlah neutronnya berbeda, sehingga menghasilkan berat atom yang berbeda.
Baca Juga: Perkembangan Teori Atom Berdasarkan Ilmuwan yang Berperan
2. Pengertian Isoton
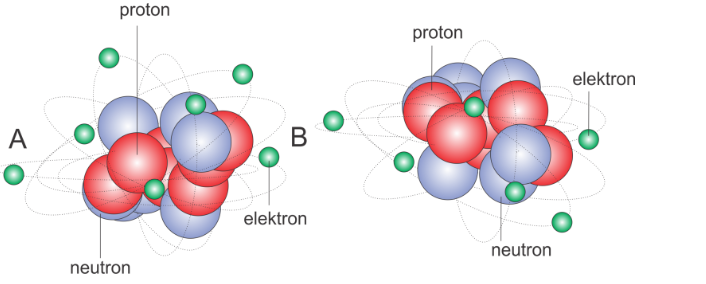
Selain itu, terdapat isoton yang konsepnya serupa dengan isotop, namun fokusnya adalah pada jumlah neutron dalam inti atom. Maka, isoton merujuk kepada atom-atom dari unsur-unsur kimia yang berbeda, tetapi memiliki jumlah neutron yang identik.
Dengan kata lain, isoton memiliki jumlah neutron yang sama meskipun memiliki jumlah proton yang berbeda. Isoton biasanya adalah isotop dari unsur-unsur kimia yang berbeda. Contohnya adalah deuterium (H-2), dan isotop helium-4 (He-4) keduanya adalah isoton karena jumlah neutronnya sama dalam inti atomnya.
3. Pengertian Isobar

Sementara isobar memiliki konsep yang berbeda dari isotop dan isoton. Isobar merujuk kepada atom-atom dari unsur-unsur kimia yang berbeda, tetapi memiliki jumlah massa atom yang sama atau berat atom yang identik. Artinya, jumlah proton dan neutron dalam inti atom isobar berbeda, sehingga sifat kimianya juga berbeda.
Ciri-Ciri Masing-Masing Isotop Isoton Isobar
Selanjutnya, mari kita bahas ciri-ciri masing-masing jenis isotop isoton isobar. Berikut ini penjelasannya:
1. Ciri-Ciri Isotop
Beberapa ciri-ciri isotop adalah sebagai berikut:
- Memiliki jumlah proton yang sama.
- Semua isotop dari unsur kimia memiliki nomor atom yang sama, sehingga dapat menentukan identitas unsur tersebut dalam tabel periodik.
- Sementara itu, isotop-isotop dari suatu unsur memiliki jumlah neutron yang berbeda, sehingga terdapat perbedaan pada massa atom isotop-isotop tersebut.
- Karena jumlah neutron yang berbeda, massa atom dari setiap isotop unsur tersebut akan berbeda satu sama lain.
- Selain itu, isotop juga memiliki nomor massa yang berbeda, yaitu dihitung dengan menjumlahkan total proton dan neutron dalam inti atom.
- Terakhir, isotop-isotop dari suatu unsur adalah unsur kimia yang sama, sehingga mereka memiliki sifat kimia yang serupa, seperti cara mereka berikatan dengan unsur-unsur lain dalam reaksi kimia.
2. Ciri-Ciri Isoton
Sedangkan berikut ini adalah beberapa ciri-ciri dari isoton:
- Ciri utama dari isoton adalah bahwa mereka memiliki jumlah neutron yang sama di dalam inti atom, meskipun jumlah proton (nomor atom) mereka berbeda.
- Isoton-isoton berasal dari unsur-unsur yang berbeda dengan jumlah proton yang berbeda pula.
- Maka, isoton memiliki nomor atom yang berbeda satu sama lain.
- Karena jumlah neutron yang sama, isoton-isoton akan memiliki massa atom yang berbeda berdasarkan jumlah proton dalam inti atom.
- Selain itu, isoton-isoton umumnya berasal dari unsur-unsur yang berbeda di dalam tabel periodik, sehingga mereka memiliki sifat kimia yang berbeda dan dapat ditemukan dalam unsur-unsur yang berbeda.
- Isoton biasanya merupakan isotop dari unsur-unsur yang berbeda.
3. Ciri-Ciri Isobar
Berbeda dengan isotop dan isoton, ciri-ciri isobar adalah:
- Isobar-isobar memiliki massa atom yang sama, yang berarti jumlah total proton dan neutron dalam inti atom mereka adalah sama.
- Namun, isobar memiliki jumlah proton dan neutron masing-masingnya berbeda, sehingga mengakibatkan nomor atom yang berbeda pula.
- Selain itu, isobar-isobar umumnya berasal dari unsur-unsur kimia yang berbeda dalam tabel periodik, sehingga mereka ditemukan dalam unsur-unsur yang berbeda pula.
- Meskipun mereka memiliki massa atom yang sama, sifat-sifat kimia mereka akan berbeda karena jumlah proton yang berbeda dalam inti atom.
Baca Juga: Kesetimbangan Kimia: Pengertian, Jenis, Reaksi, dan Contoh Soal
Contoh-Contoh Isotop, Isoton, dan Isobar serta Kegunaannya
Bagian ini akan memberikan contoh-contoh isotop isoton isobar sehingga bisa memperdalam pemahaman Anda:
1. Contoh-Contoh Isotop dan Kegunaannya
Contoh-contoh isotop dan kegunaannya adalah sebagai berikut:
a. Hidrogen (H)
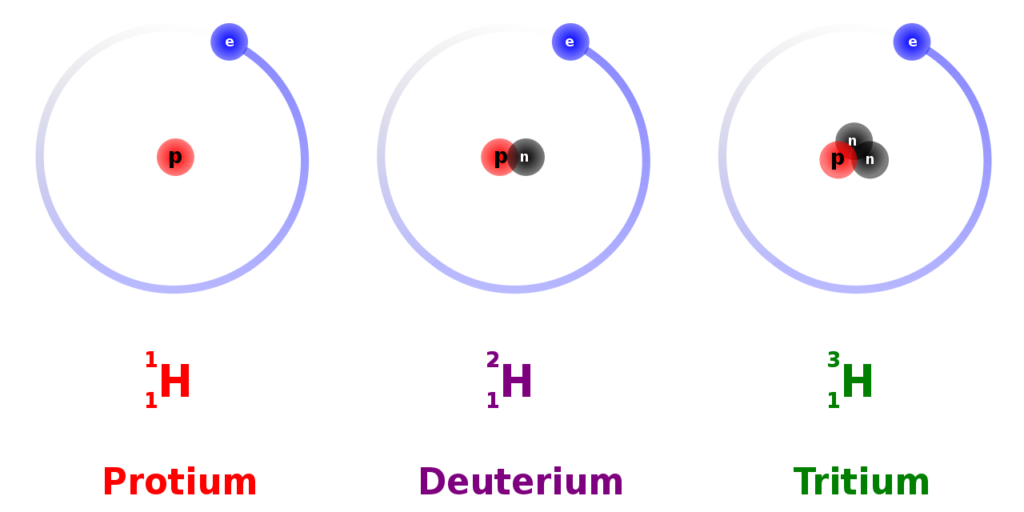
Isotop Protium (H-1) adalah isotop paling umum dari hidrogen yang memiliki satu proton, satu elektron, dan tidak ada neutron dalam inti atomnya. H-1 berfungsi dalam reaksi nuklir dan sebagai bahan bakar dalam reaktor nuklir.
Sedangkan Deuterium (2H) adalah isotop hidrogen dengan satu proton dan satu neutron dalam inti atomnya. Isotop H-2 berguna dalam produksi air berat untuk reaktor nuklir dan dalam industri nuklir.
Selain itu, tritium (3H) adalah isotop hidrogen dengan satu proton dan tiga neutron dalam inti atomnya. Sementara H-3 aplikasinya adalah dalam pembuatan senjata nuklir dan juga dalam penandaan dalam penelitian.
b. Karbon (C)
Isotop Karbon-12 (C-12) adalah isotop paling umum dari karbon. C-12 berguna dalam penentuan berat atom standar. Selain itu terdapat juga karbon-13 (C-13) sebagai isotop karbon yang berfungsi dalam penelitian isotop dan pemetaan karbon dalam senyawa kimia.
Sementara karbon-14 (C-14) adalah isotop karbon radioaktif. Kegunaannya yaitu dalam penanggalan radiokarbon untuk menentukan usia benda-benda arkeologi dan geologi.
Selain dua contoh di atas, berikut adalah contoh-contoh isotop lainnya:
- Oksigen, isotopnya yaitu 16O8, 17O8 dan 18O8
- Nitrogen, isotopnya yaitu 14N7 dan 15N7
- Helium, isotopnya yaitu 3He2 dan 4He2
- Klorin, isotopnya yaitu 35Cl17 dan 37Cl17
- Besi, isotopnya yaitu 54Fe26, 55Fe26, 56Fe26,57Fe26 dan 58Fe26
- Neon, isotopnya yaitu 20Ne10, 21Ne10 dan 22Ne10
- Natrium, isotopnya yaitu 22Na11, 23Na11 dan 24Na11
- Belerang, isotopnya yaitu 32S16, 33S16, 34S16 dan 36S16
2. Contoh-Contoh Isoton dan Kegunaannya
Kemudian, contoh isoton sederhana dan kegunaannya bisa Anda lihat pada H-1 dan He-2. Hidrogen-1 (H-1) memiliki satu proton tetapi tidak memiliki neutron. H-2 adalah isotop yang paling melimpah dalam alam.
Sementara Helium-2 (2He) adalah isoton dari H-1 dengan satu proton dan satu neutron. Kegunaannya sendiri adalah dalam penelitian nuklir sebagai pelacak reaksi nuklir. Selain H-1 dan He-2, inilah contoh lain isoton-isoton yang ada di alam:
- Argon (40Ar18) dan Kalsium (42Ca20) memiliki neutron dengan jumlah yang sama, yaitu 22.
- Nitrogen(14N7) dan Karbon (13C6) memiliki neutron dengan jumlah yang sama, yaitu 7.
- Natrium (23Na11) dan Magnesium (24Mg12) memiliki neutron dengan jumlah yang sama, yaitu 12.
- Kalium (39K19) dan Kalsium (40Ca20) memiliki neutron dengan jumlah yang sama, yaitu 20.
3. Contoh-Contoh Isobar dan Kegunaannya
Selain isotop dan isoton, terdapat isobar dengan contoh-contoh sebagai berikut:
a. Cl-35 dan Ar-37
Klorin-35 (Cl-35) memiliki isobar dengan 18 proton, 17 neutron, dan 17 elektron. Cl-35 adalah isotop paling melimpah dari klorin yang mana berguna dalam penelitian kimia dan analisis spektrometri massa.
Isobar dari klorin yang pertama adalah Argon-37 (Ar-37) dengan 18 proton, 19 neutron, dan 18 elektron. Kegunaanya yaitu dalam penelitian geologi dan dalam penanggalan radiometrik.
b. K-39 dan Ca-39
Kalium-39 (K-39) memiliki isobar dengan 19 proton, 20 neutron, dan 19 elektron. Sebagai isotop paling melimpah dari potasium, K-39 berguna dalam penelitian geokimia.
Selain itu terdapat kalium-39 (Ca-39) yang merupakan isobar dengan 19 proton, 20 neutron, dan 19 elektron. Kegunaannya adalah dalam penelitian fisika nuklir. Selain kedua contoh tersebut, berikut adalah contoh-contoh lain dari isobar:
- Natrium dan Magnesium dengan nomor massa yang sama, yaitu 24Na11 dan 24Mg12
- Hidrogen dan Helium dengan nomor massa yang sama, yaitu 3H1 dan 3He2
- Karbon dan Nitrogen dengan nomor massa yang sama, yaitu 14C6 dan 14N7
Sudah Paham Isotop, Isoton, dan Isobar Sebagai Variasi Atom?
Demikianlah artikel mengenai perbedaan dan contoh-contoh isotop isoton isobar. Untuk memudahkan dalam mengingat, isotop berasal dari unsur-unsur yang sama, sedangkan isoton dan isobar dari unsur yang berbeda. Jadi, sifat isotop-isotop akan sama, sementara isobar dan isoton memiliki sifat yang berbeda.
Mempelajari ketiga konsep atom ini memerlukan pemahaman mendalam tentang kimia dan fisika atom. Gunakan sumber daya ilmiah, buku teks, video pembelajaran, atau kursus online yang tersedia untuk memperdalam pemahaman Anda. Selain itu, berdiskusilah dengan dosen atau tutor jika Anda menghadapi kesulitan.